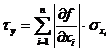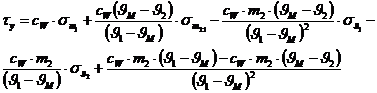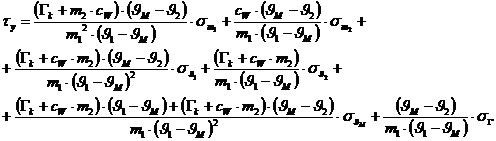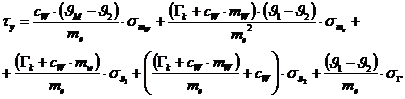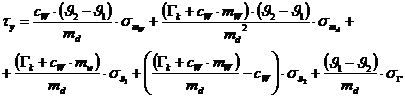Grundpraktikum
I
Kalorimetrie
Versuchsaufgabe
Ziel des Versuches ist es, spezifische
Wärmekapazitäten fester Körper sowie latente Wärmen eines Stoffes zu ermitteln.
Dazu muss zuerst die Wärmekapazität des im Versuch verwendeten Gefäßes, das
sogenannte Kalorimeters, bestimmt werden.
Diese Wärmekapazität des Kalorimeters, die sowohl mit als auch ohne
Rührer bestimmt wurde, wird dann benötigt, um die spezifische Wärme und die
latenten Wärmen in den darauffolgenden Versuchen auszurechnen.
Grundlagen
Spezifische Wärmekapazität
Führt man einem Körper eine bestimmte Wärmemenge DQ zu, so steigt seine
Temperatur um D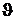 an, vorausgesetzt, dass er seinen Aggregatzustand beibehält.
an, vorausgesetzt, dass er seinen Aggregatzustand beibehält.
Den Quotienten nennt man Wärmekapazität eines Körpers:
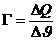
in J/K
Bezieht man diese Wärmekapazität nun auf die Masse bzw. die Stoffmenge
eines Körpers, so erhält man folgende stoffabhängige Größen:
- Die
stoffabhängige spezifische Wärmekapazität:
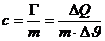 in J/(kg.K)
in J/(kg.K)
- Die
stoffabhängige molare Wärmekapazität:
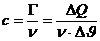 in J/(mol.K)
in J/(mol.K)
Historische Definition der Einheit Wärmemenge:
Eine Kilokalorie (kcal.) ist jene Wärmemenge, welche bei Normdruck
(p=1033 mbar) ein Kilogramm Wasser von 14,5°C auf 15,5°C, also um 1°C=1K
erwärmt.
Die Energieeinheit des SI - System ist aber das Joule. Es gilt folgende
Umrechnung:
1 kcal. = 1000 cal
=4,1868.10³ J
Dies ist die spezifische Wärmekapazität des Wassers. Sie ist weitgehend
temperaturunabhängig.
Latente Wärmen
Erfährt ein
Stoff durch Zu- oder Abfuhr von Wärmeenergie eine Zustandsänderung (allgemeiner
eine Strukturänderung), dann bleibt während des ganzen Umwandlungsvorganges die
Temperatur konstant. Die Wärmemenge, welche dabei vom Stoff aufgenommen bzw.
freigesetzt wird heißt latente Wärme.
- Spezifische
Schmelzwärme:
Wird durch Zufuhr einer
Wärmemenge DQs bei
der Schmelztemperatur Ts die
Masse m eines Stoffes zum
Schmelzen gebracht, dann nennt man das Verhältnis
die spezifische Schmelzwärme
eines Stoffes:
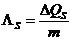 in J/kg
in J/kg
- Spezifische
Verdampfungswärme
Wird durch Zufuhr der
Wärmemenge DQv bei
der Verdampfungstemperatur Tv die Masse m eines Stoffes vom festen
oder flüssigen Zustand in den Dampfzustand übergeführt, dann nennt man das Verhältnis die spezifische
Verdampfungswärme.
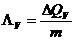 in J/kg
in J/kg
Wie bei den spezifischen
Wärmen kann man die Wärmemenge auch auf die umgewandelten Stoffmengen statt auf
die umgewandelten Massen beziehen.
Aufgaben und Auswertung
Wärmekapazität des Kalorimeters
Kalorimeter ohne Rührer:
Die Wärmekapazität des Gefäßes wird nach der Mischmethode bestimmt.
Eine bestimmte Menge Wasser der Masse m1 mit der
Temperatur  1 wurde in das Kalorimetergefäß eingewogen. In den
darauffolgenden fünf Minuten wurde dann der Temperaturverlauf aufgenommen, wobei die Temperatur mit dem
1/10 Grad Thermometer bestimmt wurde. Danach wurde eine Masse m2
kälteren Wassers der Temperatur
1 wurde in das Kalorimetergefäß eingewogen. In den
darauffolgenden fünf Minuten wurde dann der Temperaturverlauf aufgenommen, wobei die Temperatur mit dem
1/10 Grad Thermometer bestimmt wurde. Danach wurde eine Masse m2
kälteren Wassers der Temperatur 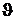 2 hinzugefügt und der Temperaturverlauf erneut für
ca. fünf Minuten aufgenommen.
2 hinzugefügt und der Temperaturverlauf erneut für
ca. fünf Minuten aufgenommen.
Messdaten:
Masse des warmen
Wasser: m1 =
97,0g 0,05g
Masse des kalten
Wassers: m2 =
93,8g 0,05g
Temperatur: D 1 = 40,0°C 0,05°C
1 = 40,0°C 0,05°C
Temperatur: D 2 = 18,0°C 0,05°C
2 = 18,0°C 0,05°C
Mischtemperatur: D M = 27,4°C 0,05°C
M = 27,4°C 0,05°C
|
Zeit (s)
|
Temp. (Grad C)
|
|
Zeit (s)
|
Temp. (Grad C)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Die von dem Kalorimeter und dem anfänglich vorhandenen Wasser
abgegebene Wärmemenge beträgt:
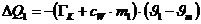
Das negative Vorzeichen bedeutet abgegebene Wärme.
Die vom
hinzugekommenen Wasser aufgenommene Wärmemenge beträgt:
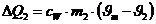
Da DQ1 +DQ2=0
(Energieerhaltung) kann man aus obigen zwei Gleichungen die Wärmekapazität des
Kalorimetergefäßes bestimmen.:
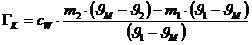
Ergebnis: 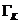 = 112,95 J/K
= 112,95 J/K
Nun wird noch der Größtfehler des berechneten Wertes ermittelt:
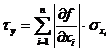
Nach Differentiation der Funktion erhält man folgende Formel:
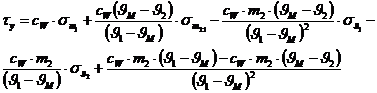
Der Größtfehler beträgt somit : J/K
Kalorimeter mit Rührer:
Die Berechnung ist ident zu der in "Kalorimeter ohne Rührer"
Messdaten:
Masse des Wasser: m1
= 94,3g 0,05g
Masse des kälteren
Wassers: m2 = 94,0g 0,05g
Temperatur: D 1 = 39,0°C 0,05°C
1 = 39,0°C 0,05°C
Temperatur: D 2 = 20,0°C 0,05°C
2 = 20,0°C 0,05°C
Mischtemperatur: D M = 27,3°C 0,05°C
M = 27,3°C 0,05°C
|
Zeit (s)
|
Temp. (Grad C)
|
|
Zeit (s)
|
Temp. (Grad C)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ergebnis: 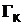 = 146,98 J/K Größtfehler: 9,87 J/K
= 146,98 J/K Größtfehler: 9,87 J/K
Wärmekapazität fester Körper
Die Wärmekapazität fester Körper wird ebenfalls nach der Mischmethode
bestimmt.
Hierzu wird eine bestimmte Menge m1 Kupferschrot im
Erwärmungsapparat nach Noak auf eine Temperatur von ca. 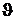 1 =100 °C erhitzt. Die Erwärmung erfolgt mittels
Wasserdampf, der in den Erwärmungsapparat eingespeist wird. Ein Thermometer
ragt bis in das Kupfer hinein, um so die genaue Temperatur zu bestimmen.
1 =100 °C erhitzt. Die Erwärmung erfolgt mittels
Wasserdampf, der in den Erwärmungsapparat eingespeist wird. Ein Thermometer
ragt bis in das Kupfer hinein, um so die genaue Temperatur zu bestimmen.
Anschließend gibt man das Kupfer in ein Kalorimetergefäß mit Rührer
(mit der im vorigen Versuch bestimmten Wärmekapazität) , welches mit Wasser der
Masse m1 und der Anfangstemperatur 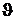 2 gefüllt ist.
2 gefüllt ist.
Messdaten:
Masse des Kupfers: m1 = 39,6g
0,05g
Temperatur des Kupfers:  1 = 98,6°C 0,05°C
1 = 98,6°C 0,05°C
Masse des Wassers: m2 = 91,7g
0,05g
Temperatur:  2 = 25,1°C 0,05°C
2 = 25,1°C 0,05°C
Mischtemperatur:  M = 28,5°C 0,05°C
M = 28,5°C 0,05°C
|
Zeit (s)
|
Temp. (Grad C)
|
|
Zeit (s)
|
Temp. (Grad C)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Die vom Kupfer abgegebene Wärmemenge beträgt:
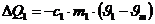
Das negative Vorzeichen bedeutet abgegebene Wärme.
Die vom Kalorimeter aufgenommene Wärmemenge beträgt:
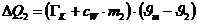
Da DQ1 +DQ2=0
(Energieerhaltung) kann man aus obigen zwei Gleichungen die Wärmekapazität des
Kupfers bestimmen.:
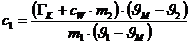
Ergebnis: c1=
469 J/(kg.K) (Tabellenwert:
c = 386 J/(kg.K) )
Nach Differentiation der Funktion erhält man folgende Formel für den
Größtfehler:
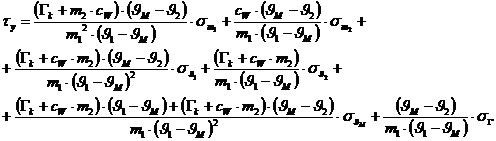
Es stellt sich heraus, dass der Größtfehler hier keinerlei Bedeutung
hat!
Schmelzwärme des Eises
In einem Kalorimeter, indem sich Wasser der Menge mW und der
Temperatur  1 befindet, werden Eisstücke der Masse me
und der Temperatur
1 befindet, werden Eisstücke der Masse me
und der Temperatur  S = 0°C zum Schmelzen gebracht.
S = 0°C zum Schmelzen gebracht.
Es stellt sich eine bestimmte Endtemperatur 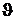 2 des
Kalorimeters ein.
2 des
Kalorimeters ein.
Wie in den vorigen Versuchen wird wieder eine Temperatur - Zeit Kurve
aufgenommen und die Temperaturdifferenz
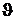 1 -
1 -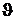 2 bestimmt.
2 bestimmt.
Messdaten:
Masse
des Eises: mE
= 30,3g 0,05g
Masse des Wassers: mW = 93,3 0,05g
Temperatur:  1 = 38,6°C 0,05°C
1 = 38,6°C 0,05°C
Endtemperatur:  M = 14,8°C 0,05°C
M = 14,8°C 0,05°C
|
Zeit (s)
|
Temp. (Grad C)
|
|
Zeit (s)
|
Temp. (Grad C)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Die vom Eis aufgenommene Wärmemenge beträgt:
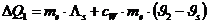
Die dem Kalorimeter entzogene Wärmemenge beträgt:
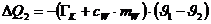
Das negative Vorzeichen bedeutet abgegebene Wärme.
Da DQ1 +DQ2=0
(Energieerhaltung) kann man aus obigen zwei Gleichungen die Schmelzwärme des
Eises bestimmen :
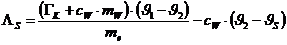
Ergebnis: 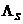 = 244,58 kJ/kg (Tabellenwert: 333 kJ/kg )
= 244,58 kJ/kg (Tabellenwert: 333 kJ/kg )
Nach Differentiation der Funktion erhält man folgende Formel für den
Größtfehler:
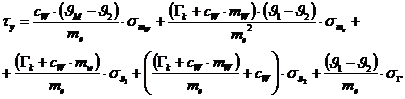
Größtfehler: 20,6 kJ/kg
Verdampfungswärme von Wasser
In ein Kalorimeter, indem sich Wasser der Menge mW und der Temperatur
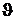 1 befindet, wird Wasserdampf der Menge md
und der Siede - Temperatur
1 befindet, wird Wasserdampf der Menge md
und der Siede - Temperatur 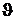 b = 100°C eingeleitet.
b = 100°C eingeleitet.
Der Wasserdampf wird folgendermaßen erzeugt:
In einem Erlenmeyerkolben wird siedendes Wasser verdampft. Der Dampf
durchläuft zunächst einen Abscheider, indem sich mitgerissenes Kondenswasser
niederschlägt. Dann erst gelangt der Dampf in das Kalorimeter. Zwischen
Kalorimeter und Dampferzeuger befindet sich ein Trennblech, um die
Wärmestrahlung des Bunsenbrenners abzuschirmen:
Es stellt sich eine bestimmte Endtemperatur 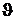 2 des
Kalorimeters ein.
2 des
Kalorimeters ein.
Wie in den vorigen Versuchen wird wieder eine Temperatur - Zeit Kurve
aufgenommen und die Temperaturdifferent
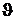 1 -
1 -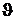 2 bestimmt.
2 bestimmt.
Messdaten:
Masse des Dampfes: mD = 22,3g 0,05g
Masse des Wassers: mW = 171,7g 0,05g
Temperatur: 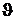 1 = 26,9°C 0,05°C
1 = 26,9°C 0,05°C
Endtemperatur: 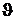 M = 81,0°C 0,05°C
M = 81,0°C 0,05°C
|
Zeit (s)
|
Temp. (Grad C)
|
|
Zeit (s)
|
Temp. (Grad C)
|
|
Zeit (s)
|
Temp. (Grad C)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Die vom Dampf an das Kalorimeter abgegebene Wärmemenge beträgt:
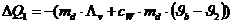
Das negative
Vorzeichen bedeutet abgegebene Wärme.
Die vom Kalorimeter aufgenommen Wärmemenge beträgt:
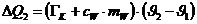
Da DQ1 +DQ2=0
(Energieerhaltung) kann man aus obigen zwei Gleichungen die Schmelzwärme des
Eises bestimmen :
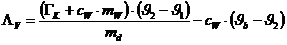
Ergebnis: 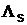 = 1,66 MJ/kg (Tabellenwert: 2,26 MJ/kg )
= 1,66 MJ/kg (Tabellenwert: 2,26 MJ/kg )
Nach Differentiation der Funktion erhält man folgende Formel für den
Größtfehler:
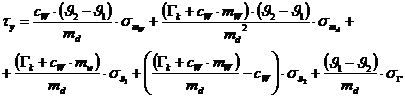
Größtfehler: 60,8 kJ/kg

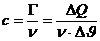 in J/(mol.K)
in J/(mol.K)