Atommodelle
I. Demokrit (460-370 v. Chr)
Es gibt kleine, unteilbare,
unveränderliche Teilchen
II. Aristoteles und Platon
- Es gibt 4 Urelemente: Wasser - Feuer - Luft - Erde



 (alchemistische Zeichen)
(alchemistische Zeichen)
III. Jhon DALTON (1766 - 1844) -
Englischer Physiker und Chemiker
Die Kleinsten Teilchen der Materie
sind die Atome, sie sind unteilbar.
Es gibt genauso viele Atomarten
wie Elemente.
Atome verschiedener Elemente unterscheiden
sich in ihrer Masse.
Verbinden sich Elemente
miteinander, so verbinden sich deren Atome in bestimmten kleinen
Zahlenverhältnisse.
Chemische Reaktionen sind
Teilchengruppierungen: Bei einer Reaktion gruppieren sich die Atome der
Ausgangsstoffe lediglich um. Weder werden Atome vernichtet, noch entstehen
neue.
DALTON wählte die Masse eines
Wasserstoffatoms als
Atommasseneinheit.
=> DALTON setzte die Masse eines
H -Atoms
willkürlich
auf 1.
Die derzeit
gültige Festlegung der Atommasseneinheit (1u) bezieht sich auf 1/12 der Masse m
des Kohlenstoffisotops 12C.
Für das H2-Atom
gilt daher: m(H) = 1.0079 u.
Hinweis: 1 u =
0,000.000.000.000.000.000.000.001.660.565.5 g
= 1,6606 * 10-27 kg
Was kann man
damit anfangen?
Element
Verbindungsbegriff
chem. Reaktion
Aggregatzustände
Lösungen
Anwendbarkeitsgrenze:
Ionengitter
Elektrolyse
Molekühlstruktur/Bindungswinkel
IV. THOMSON-Modell (1856-1940)
Faradeys
Elektrolyseversuche (1833) und die Entdeckung des Elektrons 188 konnte man mit
dem einfachen DALTON-Modell nicht mehr erklären:
=>
Ein Neues Modell muss(te) her:
THOMSON erweiterte
(um 1900) das Atommodell von DALTON in dem er die Ladung mit einbezog:
Das Atom besteht aus einer
elektrisch positiv geladenen Kugel, in die elektrisch negativ geladene
Elektronen eingelagert sind.
Die Atome sind nach außen
elektrisch neutral.
Die Atome können Elektronen auf-
und abgeben, wodurch positiv, bzw. negativ geladene Ionen entstehen.
V. Ernst RUTHERFORD (1871-1937)
V: Rutherford beschoss eine
extrem dünne Goldfolie (etwa 100 Atomschichten
stark!) mit 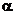 -Teilchen und stellte fest, dass einige Teilchen abgelenkt werden und einige gerade hindurch "flogen". Jedes 100.000. Teilchen etwa
prallt ganz zurück.
-Teilchen und stellte fest, dass einige Teilchen abgelenkt werden und einige gerade hindurch "flogen". Jedes 100.000. Teilchen etwa
prallt ganz zurück.
Die Beobachtungen konnten nicht mit dem THOMSON-Modell
erklärt werden. Daher geht RUTHERFORD nicht mehr vom Kugel-Modell aus:
Das Atom besteht aus einem
Atomkern und einer Atomhülle
Der Atomkern ist positiv geladen
und befindet sich im Zentrum des Atoms.
Der Atomkern hat einen Durchmesser
von 1/10.000 des gesamten Atomdurchmessers.
In der Atomhülle befinden sich
negativgeladene Elektronen die den Kern umkreisen.
Durch die Kreisbewegung wird
verhindert, dass die Elektronen auf den Kern stürzen.
Die Elektronen sind noch kleiner
als der Kern. Die Atomhülle ist praktisch ein leerer Raum.
"Kern-Hülle-Modell"
(1911)
Widerspruch zur
herkömmlichen Physik:
Bewegte Elektronen erzeugen ein
magnetisches Feld, des nach außen abgestrahlt wird. Diese Feldenergie kann nur
aus dem Energievorrat des Elektrons entnommen werden.
Bewegungsenergie de Elektrons
müsste sich verringern
Zentrifugalkraft würde sich
verkleinern
Elektron müsste spiralförmig in
den Kernstürzen.
Anwendbarkeitsgrenze: -
Molekühlstruktur/Bindungswinkel
VI. BOHRsches Atommodell (1913)
Anlass: Man
entdeckte dass Licht unterschiedlich hohe Energie hat.
Lichtentstehung durch "Bahnechsel"
des Elektrons.
Die Elektronen kreisen in sieben
Bahnen (Schalen (K-Q)) um den Kern.
Elektronen haben ein
unterschiedliches Energieniveau.
Elektronen werden durch
Kernanziehung und Fliehkraft auf bestimmten bahnen gehalten.
Maximalbesetzung: 2n²
Was kann man
damit anfangen?
Lichtentstehung
Größenverhältnisse der Atome
können abgeschätzt werden
Unterschiedliche
Ionisierungsenergie
Reaktionsfähigkeit
Bindungsbestreben der Elementatome
(Ionen-/Elektronenpaarbindung)
VII.
Orbitalmodell:
Ort und Geschwindigkeit eines
Elektrons kann nicht exakt bestimmt werden (HEISENBERGschen Unschärferelation)
Elektronen können daher keiner
bestimmten Bahn zugeordnet werden.
Elektronen bekommen einen Raum
zugeordnet indem sie wahrscheinlich zu finden sind: das Orbital.
Jedes Orbital kann maximal zwei
Elektronen mit unterschiedlichem Spin besetzt werden
Energiegleiche Orbitale mit
gleicher Nebenquantenzahl werden zuerst einfach besetzt!
