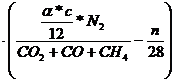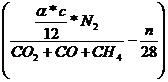Brennstoffe
Heizwert
Oberer Heizwert
Unterer Heizwert
Verbrennungsvorgang
Verbrennungsgleichungen
Ermittlung
von Sauerstoff-, Luftbedarf u. Rauchgasmenge
Verbrennungskontrolle
Verbrennungsdreiecke
BUNTE - Dreieck
Ostwald - Dreieck
Enthalpie
- Temperatur - Diagramm
Im Brennstoff ist
Energie chemisch gebunden, die durch die Verbrennung, d.h. durch Reaktion mit
Sauerstoff frei wird. Diese Energie wird vielseitig ausgenutzt (z.B. für die
Dampferzwugung, Heizungen usw.)
Man unterscheidet zwischen:
feste
Brennstoffe (z.B. Holz, Kohle)
flüssige
Brennstoffe (z.B. Heizöl)
gasförmige
Brennstoffe (z.B. Erdgas, Hochofengas)
Der Brennstoff
besteht grundsätzlich aus:
a.) brennbaren
Bestandteil b.) Ballaststoffe
Kohlenstoff C Asche
Schwefel
S Wasser
Wasserstoff
H2 Stickstoff
N2
Sauerstoff
O2
Bei festen und
flüssigen Brennstoffen werden die Mengen der vorhandenen Elemente durch eine
Analyse bestimmt und als Massenanteile (Massenprozente) angegeben.
Die Summe der
Massenanteile muss 100% ergeben.
C + s + h + a + w + n
+ o = 1 (Kleinbuchstaben stehen für
Massenanteile)
Bei Brenngasen wird
keine Elementaranalyse sondern eine Analyse der Raumanteile (Vol%) der
Einzelgase durchgeführt. Die Summe muss wieder 100% ergeben.
CO2b
+ COb + H2b + CH4b + C2H4b
+ C2H6b +
CnHmb + N2b
+ O2b = 1
Athen
(Athylen) Athan
Wenn wir diese Gase
als ideal ansehen, so sind die Raumteile gleichzeitig "Mol" - Anteile. Im
Brenngas vorhandenes H2O wird nicht als Raumanteil, sondern durch
Angabe der relativen Gasfeuchte G berücksichtigt.
Die im Brennstoff
gebundene Energie wird durch den Heizwert gekennzeichnet.
Man unterscheidet
dabei:
oberer
Heizwert HO
unterer
Heizwert HU
Als Heizwert
bezeichnet man jene Wärmemenge, welche bei vollständiger und vollkommener
Verbrennung von 1 kg (bei Gasen 1 m³) Brennstoff frei wird.
Der Unterschied
zwischen HO und HU liegt darin, dass bei HO die Kondensationswärme des bei der
Verbrennung entstandenen Wasserdampfes mit eingerechnet wird, d.h. der
Wasserdampf muss kondensiert sein.
Bei HU wird die
Kondensationswärme nicht berücksichtigt. Im Kesselbetrieb hat im allgemeinen
nur HU praktisch Bedeutung, da in den meisten Fällen die Kondensationswärme des
Wasserdampfes nicht nutzbar gemacht werden kann.
Zusammenhang: HU - HO
HU = HO
- w * r w... Wasseranteil
r..Verdampfungswärme
Auf die Masse
bezogen:
HU, HO 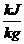
Auf die Molmasse
bezogen:
HUm, HOm  HUm
= HU*M =
HUm
= HU*M = 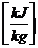
 =
= 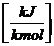
Für Gase:
HUm = HUN * Vmn 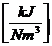
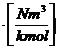 =
= 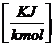
Der Heizwert kann auf
zwei Arten ermittelt werden:
Experimentell,
d.h. durch Bombenkalorimeter
Rechnerisch
mit empirischen Formeln (z.B. nach W. Boie)
Kohlenstoff,
Wasserstoff und Schwefel, bilden gasförmige Verbrennungsprodukte. Reagieren
diese Stoffe zu den Endprodukten CO2, H2O und SO2,
so wird die Verbrennung als vollständig bezeichnet.
Treten jedoch nach
der Verbrennung noch brennbare Gase wie CO, H2 und CH4
oder feste brennbare Stoffe auf, so ist die Verbrennung unvollständig.
Für eine vollständige
Verbrennung müssen folgende drei Bedingungen erfüllt sein:
erforderlicher
Sauerstoff muss vorhanden sein
Er wird meist der Umgebungsluft entnommen. In besonderen Fällen wird
auch reiner Sauerstoff verwendet, wie beispielsweise beim Schweißen zum
Erzielen hoher Temperaturen.
Zündtemperatur
muss erreicht sein
Man versteht darunter die Temperatur, bei der die Verbrennung so
schnell verläuft, dass sie unter starker Wärmeabgabe sich selbst aufrecht
erhält.
Zündgrenzen
müssen eingehalten werden
Dies ist bei
Gasen und Dämpfen wichtig, d.h. es muss die Mischung des Gases mit dem
Sauerstoff oder Verbrennungsluft örtlich stimmen. Diese sind dadurch begründet,
dass die bei der Reaktion des Gases mit dem Sauerstoff frei werdende Wärme
ausreichen muss, um eine Mindesttemperatur aufrecht zu erhalten. Das ist durch
eine kleine Luftmenge in einer großen Gasmenge nicht möglich, da dann nur ein
kleiner Teil des Brenngases reagieren kann, also nur wenig Energie frei wird.
Aber auch eine kleine Gasmenge in einer großen Luftmenge liegt
außerhalb der Zündgrenzen, da durch die kleine Gasmenge die große Gemischmenge
nicht auf der notwendigen Mindesttemperatur gehalten werden kann.
3.1 Verbrennungsgleichungen
C + O2 = CO2
C + ½ O2 =
CO
CO + ½ O2 =
CO2
H2 +
½ O2 = H2O
S + O2 = SO2
Ermittlung von Sauerstoff,- Luftbedarf und
Rauchgasmenge
Man ermittelt zuerst
für die an der Verbrennung beteiligten Elemente mit Hilfe der
Verbrennungsgleichungen die benötigte Sauerstoffmenge. Daraus ergibt sich über
den Sauerstoffanteil der Luft die erforderliche Verbrennungsluftmenge.
Für feste und
flüssige Brennstoffe gilt:
C + O2 =
CO2
 1
1 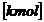 C + 1
C + 1 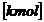 O2 = 1
O2 = 1 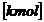 CO2
CO2
Blick
ins PSE nach Molmasse
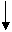 12
12 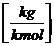 + 2 * 16
+ 2 * 16 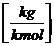 = 44
= 44 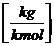 CO2
CO2
/
: 12 (um auf 1 kg C zu beziehen)
1 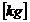 C +
C + 
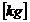 O2 =
O2 = 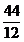
 CO2
CO2
für 1 kg Brennstoff erforderliche Sauerstoffmenge
in  :
:
c * 
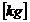 O2
O2  (für 12 kg C
brauche ich 32 kg O2)
(für 12 kg C
brauche ich 32 kg O2)
(für
1 kg C brauche ich 32/12 kg O2)
(für
c kg C brauche ich c* 32/12 kg O2)
in 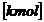 :
:
c* 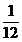
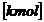 O2 ( für 12 kg C brauche ich 1 kmol O2)
O2 ( für 12 kg C brauche ich 1 kmol O2)
(für
1 kg C brauche ich 1/12 kmol O2)
(für
c kg brauche ich c* 1/12 kmol O2)
in 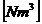 :
:
c* 1.86 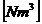 O2 m= * V V=
O2 m= * V V= 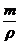 =
= 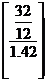 = 1.86
= 1.86 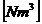
H2 + ½ O2 = H2O
1 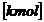 H2 + ½
H2 + ½ 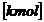 O2 = 1
O2 = 1 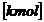 H2O
H2O
2 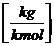 H2 + 16
H2 + 16 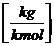 O2 = 18
O2 = 18 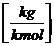 H2O
H2O
1 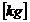 H2 + 8
H2 + 8 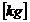 O2 = 9
O2 = 9 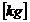 H2O
H2O
für 1 kg
Brennstoff erforderliche Sauerstoffmenge:
in 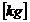 :
:
h* 8 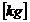 O2
O2
in 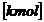 :
:
h* 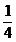
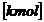 O2 (für 2 kg H brauche ich ½
kmol O2)
O2 (für 2 kg H brauche ich ½
kmol O2)
(für
1 kg H brauche ich ¼ kmol O2)
(für
h kg H brauche ich h* 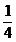 kmol O2)
kmol O2)
in 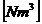 :
:
h*5.63 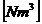 O2 V=
O2 V= 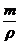 =
= 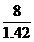 = 5.63
= 5.63 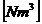
S + O2
= SO2
1 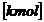 S + 1
S + 1 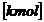 O2 = 1
O2 = 1 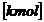 SO2
SO2
32 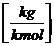 S + 32
S + 32 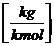 O2 = 64
O2 = 64 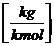 SO2
SO2
1 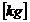 S + 1
S + 1 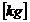 O2 = 2
O2 = 2 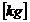 SO2
SO2
für 1 kg
Brennstoff erforderliche Sauerstoffmenge:
in 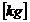 :
:
s* 1 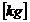 O2
O2
in 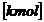 :
:
s* 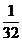
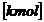 O2
O2
in 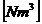 :
:
s* 0.7 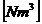 O2
O2
Der gesamte benötigte
Sauerstoffbedarf:
 Das ist bereits im Brennstoff enthalten und
brauche es nicht mehr zuführen!
Das ist bereits im Brennstoff enthalten und
brauche es nicht mehr zuführen!
O2 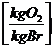 =
=  * c + 8 * h + 1 * s - 1 *o
* c + 8 * h + 1 * s - 1 *o
O2 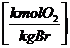 =
= 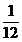 * c +
* c + 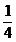 * h +
* h + 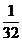 *s -
*s - 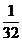 * o
* o
O2 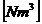 = 1,86 * c + 5,6 * h +
0,7 * s - 0,7 * o
= 1,86 * c + 5,6 * h +
0,7 * s - 0,7 * o
Bestandteile
der Luft:
Für eine einfachere
Berechnung wird der
Edelgasanteil zum
Stickstoffanteil dazugerechnet,
d.h. Stickstoffanteil
= 79 Vol%
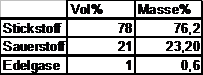
Die zur
Verbrennung benötigte Mindestluftmenge (trocken):
Lmintr = 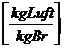 =
= 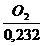
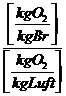


Lmintr = 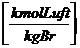 =
= 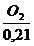
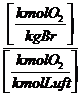 (da wir das Gas
als ideal ansehen, sind die Raumanteile (Vol%) gleich Mol-Anteile)
(da wir das Gas
als ideal ansehen, sind die Raumanteile (Vol%) gleich Mol-Anteile)
Lmintr = 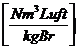 =
= 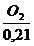
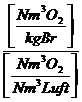
Mit
Berücksichtigung des Wasserdampfgehaltes in der Luft (Luftfeuchtigkeit):
lminf = lmintr
+ wL * lmintr = (1-wL)*lmintr
wL = Luftfeuchte
wL = 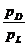 =
= 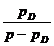 pD = Teildruck des
Wasserdampfes
pD = Teildruck des
Wasserdampfes
pL
= Teildruck der trockenen Luft
p
= Gesamtdruck
pD = * pS
= relative Luftfeuchtigkeit
= 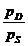
pS
= Sättigungsdruck des Wasserdampfes
wL = 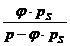
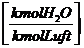
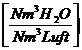
wL = 0,62* 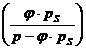
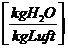 Wie kommt man zu 0,62?
Wie kommt man zu 0,62?
=
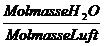 =
= 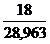 = 0,62
= 0,62
tatsächliche
Luftmenge:
ltats =
* l minf =
Luftüberschusszahl
Kohlendioxid CO2:
in 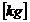 :
:
c * 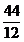
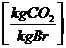
in 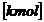 :
:
c * 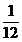
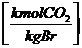
in 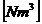 :
:
c * 1,86 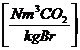
Schwefeldioxid SO2
:
in 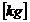 :
:
s * 2 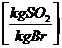
in 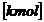 :
:
s * 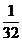
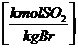
in 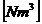 :
:
s * 0,7 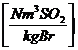
Wasser H2O :
in 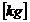 :
:
Das ist schon im Das wird durch die Verbrennungsluft
Brennstoff vorhanden zugeführt!
9 * h + w + wL * * lmin
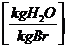 w = Wasseranteil im
Brennstoff (liegt flüssig vor)
w = Wasseranteil im
Brennstoff (liegt flüssig vor)
in 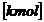 :
:
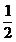 * h +
* h +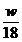 + wL * * lmin
+ wL * * lmin 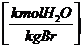
in 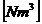 :
:

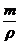 =
= 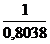
 =1,24
=1,24
11,2 * h + 1,24 * w + wL * lmin * 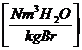
Stickstoff N2
:
in 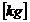 :
:
Das
führe ich durch die Verbrennungsluft zu
 Im
Brennstoff vorhanden
Im
Brennstoff vorhanden
n + 0,762 * * lmin 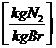
in 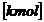 :
:
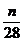 + 0,79 * * lmin
+ 0,79 * * lmin 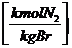
in 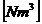 :
:
n * 0,8 + 0,79 * * lmin 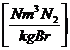
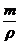 =
= 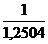 = 0,8
= 0,8
Sauerstoff O2:
in 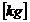 :
:
0,23 * ( - 1) * lmin 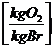
in 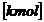 :
:
0,21 * ( - 1) * lmin 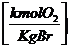
in 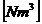 :
:
0,21 * ( - 1) * lmin 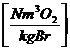
Man unterscheidet
:
trockene
min. RG - Menge
feuchte
min. RG - Menge
trockene
tats. RG - Menge
feuchte
tats. RG - Menge
zu 1. :
Vtro min
= VCO2 + VSO2 + VN2
= 1,86 * c + 0,7 * s + 0,8 * n + 0,79 * lmin 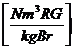
zu 2. :
V f
min = Vtr min + 11,2 * h + 1,24 * w + wL * lmin
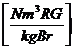
zu 3. :
Vtr tats = VCO2
+ VSO2 + VN2 +VO2
= 1,86 * c + 0,7 * s + 0,8 * n + 0,79 * * lmin
+ 0,21 * ( - 1) * lmin 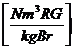
zu 4. :
V ftat
= V trtat + 11,2 * h +1,24 * w + wL * *
lmin 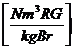
Um die Güte der Verbrennung zu überprüfen,
müssen das Luftverhältnis l, eventuell vorhandene brennbare Abgasbestandteile,
sowie die festen Rückstände ermittelt werden. Eine unmittelbare
Luftmengenmessung ist ungenau, da eventuell falsch angesaugte Luft nicht
berücksichtigt werden kann. Auch die exakte Messung der Abgasmenge ist kaum
möglich. Das Luftverhältnis und die auf die Brennstoffmenge bezogene Abgasmenge
können aber aus der Abgaszusammensetzung berechnet werden. Die Abgasanalyse
gibt somit genau Auskunft darüber, ob die Verbrennung richtig ausgeführt wird.
Abgasanalyse:
Chemische
Verfahren (Orsatgerät)
Physikalisches
Verfahren (z.B. auf Infrarotabsorptionsbasis)
Auswertung der
Messung:
Stoffbilanzen: Alle
Stoffe die der Feuerung zugeführt werden, müssen sie auch wieder verlassen.


 Brennstoff Feuchtes
Gas
Brennstoff Feuchtes
Gas
C,h,s,w,n,o,a CO2,
SO2, H2O, CO, CH4, H2, N2,
O2

 O2, N2, H2O Asche
und Unverbranntes
O2, N2, H2O Asche
und Unverbranntes
Feuchte Verbrennungsluft
Ermittlung der
Abgasmenge aus der Kohlenstoffbilanz:
INPUT = OUTPUT

 Durch Brennstoff zugeführt Gesamtes hinter "=" ist nach der
Verbrennung im Rauchgas
Durch Brennstoff zugeführt Gesamtes hinter "=" ist nach der
Verbrennung im Rauchgas


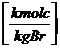 = Vtr
= Vtr 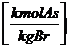 * (CO2 + CO + CH4)
* (CO2 + CO + CH4) 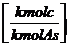 +
+ 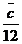
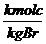 Vtr
Vtr
c - 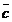 = * c =
vergaster Kohlenstoff
= * c =
vergaster Kohlenstoff
Vtr = 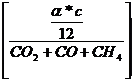
Feuchte
Abgasmenge:
Vf = Vtr
+ VH2O
Stickstoffbilanz:
Durch Verbrennungsluft zugeführt

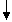

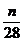 + 0,79 * * lmin = Vtr * N2
Vtr =
+ 0,79 * * lmin = Vtr * N2
Vtr = 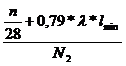
Durch Brennstoff
zugeführt Durch Abgas abgeführt
erhält man
nun durch gleichsetzen von Vtr Stickstoff und Vtr
Kohlenstoff:

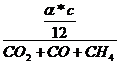 =
= 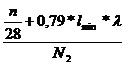
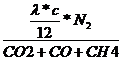 =
= 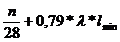
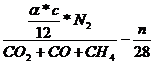 =
= 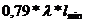
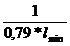
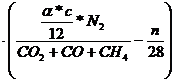
= 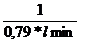
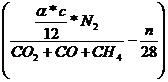
Verbrennungsdreiecke veranschaulichen den
Zusammenhang zwischen dem CO2-, O2- und CO- Gehalt des Abgases und ermöglichen
die graphische Ermittlung des Luftverhältnisses.
Man unterscheidet
zwischen:
6.1 Bunte-Dreieck
6.2 Ostwald
Dreieck
Das Ostwald - Dreieck gilt nur für einen bestimmten Brennstoff und
Verbrennung ohne feste Rückstände, jedoch wird die vollständige Verbrennung des
Kohlenstoffes erfaßt. Mit dem Ostwald - Dreieck kann das Luftverhältnis
graphisch ermittelt und die Richtigkeit der Abgasanalyse kontrolliert werden,
da durch Bestimmung zweier Abgasanteile der dritte vorliegt.
Enthalpie - Temperatur - Diagramm
Für genauere
wärmetechnischen Berechnungen wird für den jeweiligen Brennstoff ein H -t
-Diagramm erstellt. Der Wärmeinhalt des Rauchgases kann dabei entweder auf 1 m³
Rauchgas oder auf 1 kg Brennstoff bezogen
sein. Die Bezugsart aud 1 kg hat den Vorteil, dass der Heizwert unabhängig von der
Luftüberschusszahl l als horizontale Gerade festliegt. Ferner ist es günstig,
als Bezugstemperatur nicht 0°C, sondern Umgebungs- bzw. Kesselhaustemperatur
anzunehmen, da dann eventuell einströmende Falschluft Wärme mitbringt.
Zur Berechnung des
Diagramms ist die Kenntnis der spezifischen Wärme der Rauchgasbestandteile
nötig. Da die spezifische Wärme von der Temperatur abhängig ist, rechnet man
mit einem Mittelwert cpm, welcher die mittlere spezifische Wärme
zwischen den Temperaturen 0 und t [°C] darstellt und aus Tabellen entnommen
wird. Den Wärmeinhalt des gesamten Rauchgases bei t [°C] erhält man durch
Addition der Wärmeinhalte aller Rauchgasanteile. Mit steigendem l wird die
Kurve steiler, da die Rauchgasmenge pro kg Brennstoff mit höherem l steigt.
Über 1500°C muss vor allem die Aufspaltung von CO2, H2O berücksichtigt werden,
da vom Rauchgas zusätzlich Wärme aufgenommen wird, was wiederum einen steileren
Anstieg der H- t- Kurve zur Folge hat.
Der auf 1 kg
Brennstoff bezogene Wärmeinhalt eines Rauchgasanteiles beträgt bei t [°C]:
H.. = cpm.. * V..* t 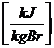
z.B. für CO2
HCO2 = cpm, CO2
* VCO2*t

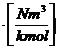 =
= 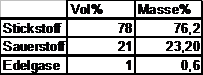
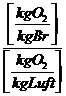
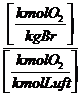 (da wir das Gas
als ideal ansehen, sind die Raumanteile (Vol%) gleich Mol-Anteile)
(da wir das Gas
als ideal ansehen, sind die Raumanteile (Vol%) gleich Mol-Anteile)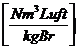 =
= 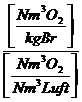
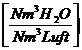
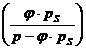
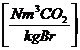
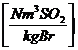

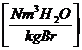
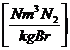
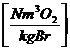
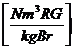
 Brennstoff
Brennstoff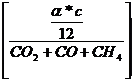
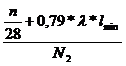
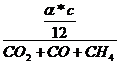 =
= 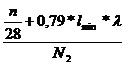
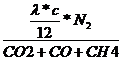 =
= 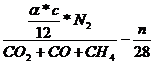 =
=