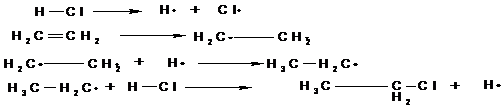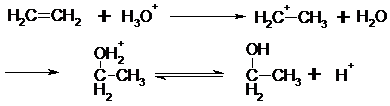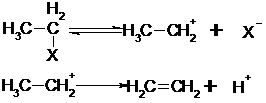Reaktionsmechanismen
in der organischen Chemie
Generell lassen sich drei verschiedene Reaktionstypen in der
organischen Chemie unterscheiden:
Substitutionsreaktionen (S-Reaktion)
Additionsreaktionen (A-Reaktion)
Eliminierungsreaktionen (E-Reaktion)
Substitutionsreaktionen
Radikalische
Substitution
Radikalische Substitutionsreaktionen laufen in drei Reaktionschritten
ab:
Startreaktion
Ein Radikalbildnermolekül wird unter Energiezufuhr, z.B. Licht
(Photolyse) oder Wärme (Thermolyse) in homolytisch, d.h. in zwei gleiche Radikale
( Verbindungen mit einem ungepaarten Elektron) gespalten.
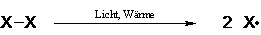 Kettenreaktion
Kettenreaktion
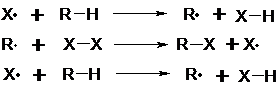
Die durch die Startreaktion entstandenen Moleküle entreißen dem
Kohlenwasserstoffmolekül, an dem Substitution stattfinden soll, ein H-Atom. Es
entsteht ein neues Kohlenwasserstoff-Radikal. Dieses kann nun seinerseits aus
einem Substituentenmolekül ( oben mit X-X gekennzeichnet) eine
Substituentengruppe abspalten. Dabei entsteht erneut ein Radikal, so daß die
Reaktion den Zyklus weiter durchlaufen kann ( die neu entstandenen Radikale ersetzen wiederum H-Atome usf.).
Kettenabbruchsreaktion
Die Reaktion kommt beispielsweise durch Rekombination
zweier Radikale zum Stillstand.
Eine zweite Möglichkeit des Kettenabbruchs ist eine
sog. Disproportionierung, d.h. daß bei zwei radikalischen Molekülen zum einen
die Oxidationszahlen des beteiligten Kohlenstoffs sinken, beim anderen steigen
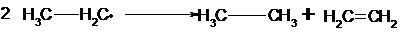
Beispiel:
Nukleophile Substitution (SN - Reaktionstyp)
Allgemein gesehen ist eine nukleophile Reaktion eine chemische
Umsetzung, in der ein nukleophiles ( d.h. entweder negativ geladenes oder
polarisiertes oder ein solches mit freiem Elektronenpaar) Reagens einen
Molekülbereich, in dem Elektronenmangel herrscht, angreift. Ein nukleophiles
Reagens oder Agens gibt Elektronen an das Substrat ab, wirkt also als
Reduktionsmittel.
Man unterscheidet zwei unterschiedliche Mechanismen: SN1-
und SN2-Reaktionen.
SN1-Reaktion
( monomolekulare nukleophile Substitution)
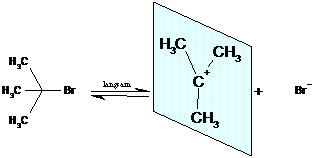
Dieser Mechanismus soll im folgenden exemplarisch an der Umsetzung von
2-Brom-2-Methylpropan mit OH- erläutert werden.
In einer langsam laufenden Reaktionsschritt
(geschwindigkeitsbestimmend) wird zunächst das 2-Brom-2-Methylpropan unter
Mitwirkung des Lösemittels Wasser gespalten.
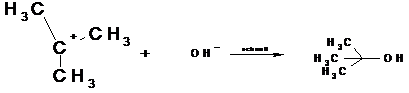
Das sich bildende, positive Carbeniumion ist planar
gebaut ( angedeutet durch die eingezeichnete Ebene). Es stabilisiert sich in
einem zweiten Reaktionschritt durch eine schnelle Ionenreaktion mit OH-. Die
Anlagerung kann von beiden Seiten erfolgen.
Die Reaktionsgeschwindigkeit der SN1- Reaktion ist nur von
der Konzentration des Substrats abhängig, nicht von der OH- -
Konzentration.
SN2 -
Reaktion (bimolekulare nukleophile Substitution)
Eine Reaktion nach diesem Mechanismus kann erfolgen, wenn das
nukleophile Reagens auf der der zu substituierenden Gruppe abgewandten
Molekülseite liegt. Bei einer Annäherung beider Reaktionspartner kommt es zu
einem planaren Übergangszustand, in dem sowohl die eintretende Gruppe schon als
auch die austretende noch locker an das zentrale C-Atom gebunden sind.
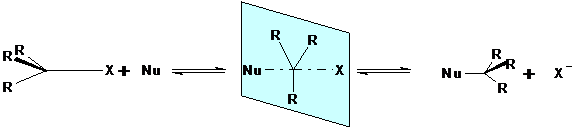
Der Übergangszustand stabilisiert sich durch Abgabe
der zu substituierenden Gruppe. Hierbei findet eine räumliche Umordnung der
Reste nach Art eines umgestülpten Regenschirms statt. Dieses stereometrische
Phänomen wird Waldensche Umkehrung genannt. Die Reaktionsgeschwindigkeit hängt
von der Konzentration beider Reaktionspartner ab.
Elektrophile Substitution (SE-Reaktionstyp)
Eine elektrophile Reaktion ist ein chemischer Vorgang,
bei dem ein Reagens ein elektronenreiches Zentrum im Substrat angreift. Den
angreifenden Reaktionspartner nennt man elektrophiles Reagens. Dieses nimmt
Elektronen auf, wirkt also als Oxidationsmittel.
Die elektrophile Substitution ist die typische
Reaktion für die Substitution an aromatischen Systemen. Als Beispiel soll die
Bromierung von Benzol dienen.
Die Reaktion beginnt mit der annäherung eines Brommoleküls an die
delokalisierten p-Elektronen des aromatischen Systems. Diese lose
Wechselwirkung wird p-Komplex genannt.
Das nun polarisierte Brommolekül wird durch eine Lewis-Säure
(Verbindung mit Elektronenlücke, z.B. FeBr3) gespalten. Das positivierte
Bromatom lagert sich unter Ausbildung einer s-Bindung
an das aromatische System an, es kommt zur Ausbildung eines s-Komplexes.
Der s-Komplex ist relativ instabil, da der die Homogenität
des aromatischen Systems stört. Er stabilisiert sich durch Abspaltung eines H+.
Additionsreaktionen
Radikalische
Addition (AR-Reaktionstyp)
Eliminierungsreaktion
Eliminierungen kann man als Umkehrung der Addition auffassen.
Im ersten Reaktionsschritt kommt es zur Bildung eines Carbeniumsions
durch X aus dem Molekülverband. Dieser langsame Primärschritt bestimmt die
Geschwindigkeit der Reaktion.
Der zweite
Reaktionsschritt: ein Proton löst sich, wodurch das im ersten Reaktionsschritt
gebildete Ion vernichtet und das Gesamtmolekül stabilisiert wird.

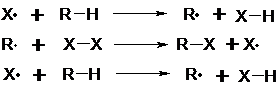

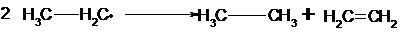


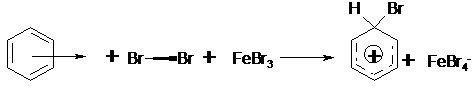
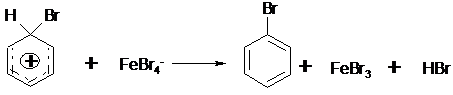 entkoppeln und damit
den Reaktionsstart einzuleiten. Dabei
reagiert das Radikal mit einem durch die Entkoppelung ungepaart vorliegenden
Elektron. Die folge ist die Bildung eines C-Radikals, das seinerseits mit einem
aus dem angreifenden Reagens gebildeten Radikal unter Absättigung reagiert.
entkoppeln und damit
den Reaktionsstart einzuleiten. Dabei
reagiert das Radikal mit einem durch die Entkoppelung ungepaart vorliegenden
Elektron. Die folge ist die Bildung eines C-Radikals, das seinerseits mit einem
aus dem angreifenden Reagens gebildeten Radikal unter Absättigung reagiert.