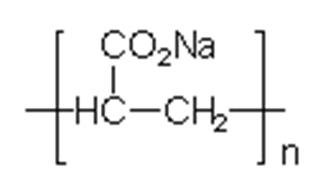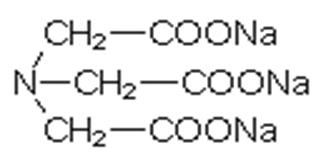Referat Chemie-Spezialgebiet - Waschmittel und Seifen - Geschichte der Waschmittel und Seifen, Herstellung von Seife, Aufbau und Wirkungsweise von Tensiden, Bestandteile moderner Waschmittel
Chemie-Spezialgebiet
Waschmittel
und
Seifen
Geschichte der
Waschmittel und Seifen
Das vermutlich
erste Seifenrezept wurde ca. 2500 v. Chr. In Mesopotamien niedergeschrieben,
welches gleichzeitig das erste Dokument über eine gezielt vom Menschen
durchgeführte chemische Reaktion war. Es beinhaltet Öl und Pottasche welche im
Verhältnis 2:11 gemischt werden müssen. Pottasche wurde durch Verbrennen von
Pflanzen, wie z.B. Dattelpalmen oder Tannenzapfen gewonnen, deren Asche reich
an Kalium war. Als eigentlich waschwirksame Substanz bildete sich unter anderem
das Alkali Kaliumcarbonat (K2CO3).
Die Agypter
verwendeten zum Waschen ihrer Kleidung Soda (Na2CO3),
welches sie durch verbrennen von Meerespflanzen, welche NaCl beinhalten,
gewannen oder sie fanden es als Mineral in der Wüste (ausgetrocknete Salzseen,
Bodenkruste). Bis zum Jahr 1794 (siehe
Leblanc-Verfahren) wurde diese Art Soda zu gewinnen nur geringfügig
geändert
Seife stellten die
Agypter durch verkochen von Natronlauge mit Fetten oder Ölen her, jedoch wurde
Seife seinerzeit wie eine Medizin gehandhabt, da deren reinigende Wirkung Hautkrankheiten
"heilte", die durch mangelnde Körperhygiene entstanden waren.
Erst nach Christi
Geburt um das Jahr 25 finden sich erneut Aufzeichnungen über die Verwendung von
Seifen. Es handelte sich um hierbei um Aufzeichnungen der alten Römer, welche
Pottasche mit zersetztem, verfaultem Urin vermischten um ihre Kleidung zu
reinigen.
Beim Zersetzen des
Urins entsteht Ammoniak, welcher genauso ein Alkali wie Kaliumcarbonat ist.
Im 7. und 8.
Jahrhundert n. Chr. stellten die Araber die ersten festen Kaliseifen mittels
"kaustifizieren" (alkalisch machen) von Soda oder Pottasche mit
Calciumhydrooxid (Ca(OH)2, auch Atzkalk genannt) her. Durch die
Ausbreitung der Religion gelangte die Technik des Seifensiedens schließlich
auch nach Europa. Vor allem der Mittelmeerraum wurde zu einem Zentrum der
Seifensiederei, da hier Oliven, aus denen das zur Seifenproduktion nötige Öl
gewonnen wurde, und Meerespflanzen, deren Asche sodahältig ist, zahlreich
vorhanden waren. In Frankreich wurden außerdem erstmals Duftstoffe zugesetzt,
die aus verschiedenen Pflanzen gewonnen wurden.
Anfang des 19.
Jahrhunderts stieg mit der Industrialisierung und dem damit verbundenen
Aufschwung der Textilindustrie die Nachfrage nach Seife. Es entstand ein
Engpass an Rohstoffen, Talg und Holzasche konnten nicht mehr in ausreichendem
Maße geliefert werden. 1794 entwickelte jedoch Nicolas Leblanc ein neuartiges
Verfahren zur Sodaherstellung, das diesen Engpass löste.
Das Leblanc-Verfahren
Beim
Leblanc-Verfahren wird aus Natriumchlorid (NaCl) und Schwefelsäure (H2SO4)
Natriumsulfat (Na2SO4) hergestellt, welches wiederum mit
Kohle (C) und Kalk (CaCO3) erhitzt wird:
Na2SO4 + CaCO3
+ 2 C → Na2CO3
+ CaS + 2 CO2
Da bei diesem
Verfahren jedoch hohe Energiemengen verbraucht wurden und außerdem als
Abfallprodukt Calciumsulfid (CaS) entstand wurde es 1861 vom Solvay-Verfahren
(Ammoniak-Soda-Verfahren), benannt nach dem Erfinder Ernest Solvay, abgelöst.
Das
Solvay-Verfahren
Hierbei
wird zuerst mittels Einleitung von Ammoniak (NH3) und Kohlendioxid
(CO2) in eine fast gesättigte Kochsalzlösung (NaCl)
Ammoniumhydrogencarbonat (NH4HCO3) hergestellt, welches
sich mit dem Kochsalz zu Natriumhydrogencarbonat (NH4HCO3)
umsetzt.
NH4HCO3
+ NaCl → NaHCO3 + NH4Cl
Anschließend
wird das Natriumhydrogencarbonat (NaHCO3) calciniert (erhitzt)
wodurch Natriumcarbonat, Wasser und Kohlendioxid entsteht:
2 NaHCO3 → Na2CO3 + H2O + CO2
Das
freigewordene Kohlendioxid fällt nicht als Abfallprodukt an, sondern wird
wieder in die Kochsalzlösung zurückgeführt. Ammoniak wird aus dem zuvor
entstandenen Ammoniumchlorid (NH4Cl) hergestellt, indem es mit
gebranntem Kalk (CaO) reagiert:
2 NH4Cl + CaO → 2 NH3 + H2O + CaCl2
1907 kam das erste
Vollwaschmittel namens "Persil" auf den Markt. Es setzte sich aus Seifenpulver,
Natriumperborat, welches als Bleichmittel wirkte, und Natriumsilicat als
Stabilisator zusammen.
Die Entwicklung der
Waschrohstoffchemie, wie wir sie heute kennen, begann erst im 20. Jahrhundert.
Waschmittel sind multifunktionell geworden,
Herstellung von Seife
Früher wurden
tierische oder pflanzliche Fette wie Olivenöl oder Palmöl mit Natronlauge
längere Zeit erhitzt, dabei wird das Fett in Glycerin und die Anionen der
Fettsäuren gespalten.
Dieser Vorgang wird
Neutralölverseifung genannt:
Neutralölverseifung:
Beispiel:
Abb. 5.1:
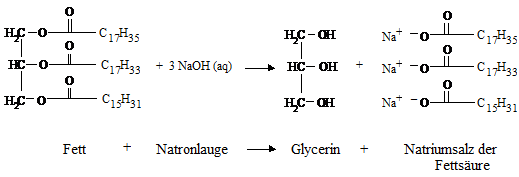
Bei
der Seifenherstellung wird der Ester (Fett oder Öl) durch die Hydrooxid-Ionen
der Lauge unter Hitze aufgespalten. Es entsteht der sogenannte Seifenleim,
welcher aus Glycerin, Natronlauge, unverseiften Fettresten und der eigentlichen
Seife, den Alkalisalzen der Fettsäure besteht..
Durch
Zugabe von NaCl wird die Löslichkeit der Seife herabgesetzt und es bildet sich
eine wässrige Lösung und die Seife, die auf der wässrigen Lösung schwimmt.
Diesen Vorgang, "aussalzen" genannt, wird wiederholt durchgeführt um den
Reinheitsgrad der Seife zu erhöhen.
Die
mit Natronlauge hergestellte Natronseife ist hart (Kernseife), die mit
Kalilauge hergestellte Seife ist halbfeste bis flüssig (Schmierseife).
Industriell hergestellte Seife wird heute
großteils mittels Fettsäure-Verseifung hergestellt.
Fettsäure-Verseifung:
Dieses Verfahren teilt sich in 2
Abschnitte.
Im ersten Abschnitt erfolgt die sogenannte hydrolitische Spaltung, bei
der Fette durch heißen Wasserdampf (ca. 180sC), unter hohem Druck und mittels
eines Katalysators zu Glycerin und Fettsäuren gespalten werden.
Die so gewonnenen Fettsäuren werden im zweiten Abschnitt mittels
Natriumcarbonatlösung oder Natronlauge neutralisiert.
Beim Carbonatverfahren wird die Fettsäure in eine siedende
Natriumcarbonat-Lösung gebracht. Man lässt die Lösung so lange sieden, bis das
Kohlenstoffdioxid vollständig ausgetreten ist. Übrig bleibt die auf der
restlichen Flüssigkeit schwimmende Kernseife.
(BILD EINFÜGEN)
Beim Laugenverfahren werden Fettsäuren mit Natronlauge neutralisiert.
(BILD EINFÜGEN)
Anschließend werden noch eventuell
Desinfektionsmittel sowie Duft- oder Farbstoffe hinzugefügt, bevor die Seife
fertig für den Handel ist.
Aufbau und
Wirkungsweise von Tensiden
Aufbau:
Alle Tenside sind nach dem selben Prinzip
aufgebaut, sie besitzen einen polaren und einen unpolaren Teil. Folglich sieht
ein Tensid vereinfacht dargestellt so aus:

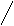
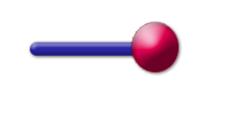 Abb. 7.1:
Abb. 7.1:
Der unpolare
(hydrophobe) Teil steht für einen linearen, verzweigten oder ringförmigen
Kohlenwasserstoffrest. Tenside werden aber im allgemeinen nach Art und Ladung
des polaren (hydrophilen) "Kopfs" klassifiziert. Hierbei können vier Gruppen
unterschieden werden: Aniontenside, Kationentenside,amphoterme und
nichtionische Tenside (Niotenside).
Lösung von
Tensiden in Wasser
Bei einer geringen
Konzentration an Seifenanionen reichern sich diese zuerst an der
Wasseroberfläche an, da dieser Zustand für sie energetisch am günstigsten ist -
die hydrophilen Gruppen der Seifenanionen richten sich so aus, dass sie Kontakt
mit dem Wasser haben, die hydrophoben hingegen so, dass sie aus dem Wasser
herausragen und somit eine Wechselwirkung mit dem Wasser vermeiden. Bei
zunehmender Konzentration wird diese Grenzfläche vollständig mit einer Schicht
von Seifenanionen bedeckt (monomolekulare Seifenschicht). An der
Wasseroberfläche befinden sich nun zwischen den Wassermolekülen die hydrophilen
Teile der Seifenanionen. Dadurch wird die starke Anziehung zwischen den
Wassermolekülen vermindert und es nimmt in Folge die Oberflächenspannung ab.
Das Abnehmen der Oberflächenspannung hat auch das Abnehmen der
Grenzflächenspannung z.B. zwischen Wasser und Öl zur Folge. Ursache für die
Ausbildung von Grenzflächen zwischen zwei Flüssigkeiten ist die unterschiedlich
großen Oberflächenspannungen. Je größer die Differenz ist, desto größer ist
auch die Grenzflächenspannung. Ist die Oberflächenspannung jedoch gleich groß,
verschwindet die Grenzfläche.
Wird nun weitere
Seife gelöst, findet man Seifenanionen auch im Inneren der Lösung. Es entstehen
sogenannte Micellen (das sind Teilchenverbände aus 50 bis 1000
Seifenanionen, die so angeordnet sind, dass die hydrophoben Teile der Seifenanionen
ins Innere der Micelle zeigen), da der hydrophobe Teil versucht, sich der
Wechselwirkung mit dem Wasser zu entziehen. Der hydrophile Teil der
Seifenanionen ist jedoch immer den Wassermolekülen zugewandt.
Abb. 8.1:
Zwischen den
Seifenanionen an der Oberfläche, den Seifenanionen der Micellen und einzelnen
Seifenanionen in der Lösung besteht ein dynamisches Gleichgewicht, daher
ständig gelangen Seifenanionen in die Micellen, treten aus Micellen aus,
gelangen an die Oberfläche oder verlassen die monomolekulare Seifenschicht der
Oberfläche.
Der Beginn der
Micellbildung wird als kritische Micellbildungskonzentration bezeichnet
und ist ein charakteristischer Zahlenwert für jedes Tensid.Da die Micellbildung
genau bei der Stelle stattfindet bei der die Oberfläche mit Seifenanionen
bedeckt ist, ändert eine weitere Seifenzugabe nichts an der Oberflächenspannung
der Flüssigkeit. Waschwirkung und Schaumbildung treten erst auf, wenn die
kritische Micellbildungskonzentration überschritten wurde.
Die
waschaktive Wirkung von Tensiden (am Beispiel
der anionischen Tenside)
Da Wasser eine hohe
Oberflächenspannung hat, perlt es im Normalfall auf festen Oberflächen und kann
daher die Fasern bzw. den Schmutz nicht vollständig benetzen. Eine Seifenlösung
hingegen, kann auf Grund der niedrigeren Oberflächenspannung bis an die Faser-
und Schmutzoberfläche vordringen. Dadurch können z.B. auch hydrophobe Textilien
benetzt werden.
Abb. 8.2:
|
Wassertropfen auf einer Textiloberfläche
|
|
vor und nach Seifenzugabe
|
Die Seifenmoleküle
lagern sich, bedingt durch die Grenzflächenaktivität, wie schon zuvor bei Luft
und Wasser beschrieben, bevorzugt an der Grenzfläche zwischen Wasser und
Textiloberfläche an. Sowohl Faser als auch Schmutz werden also von einer
Seifenanionenschicht umgeben, wobei der hydrophile Teil wiederum in die
wässrige Lösung ragt.
Abb. 9.1:
Anlagern der Tenside an der Oberfläche des Schmutzes
und des Textils
Der Schmutz wird
nun von der Oberfläche abgelöst. Dieser Vorgang wird dadurch unterstützt, dass
sich die Tensidmoleküle auch an der Oberfläche des Textils angelagert haben.
Die Tensidmoleküle sind negativ geladen, so dass es zwischen der mit
Tensidmolekülen belegten Oberfläche und den mit Tensidmolekülen belegten
Schmutzpartikeln zu einer elektrostatischen Abstoßung kommt.
Abb. 9.2:
Elektrostatische Abstoßung der Tenside - Schmutz löst
sich
Die
elektrostatische Abstoßung bewirkt auch eine Zerteilung der Schmutzpartikel
sowie ein erneutes Zusammensetzen dieser untereinander oder mit dem Textil, da
sie von Tensiden umgeben sind.
Abb. 9.3:
Zerteilung der Schmutzpartikel
Zur restlosen Beseitigung des Schmutzes ist
jedoch auch mechanische Bewegung nötig, daher bestimmt die Bewegung der Wäsche
während dem Waschvorgang die erzielte Reinheit mit.
Bestandteile
moderner Waschmittel:
Waschmittel haben
heutzutage eine Vielzahl an Anforderungen zu erfüllen. Qualitative
Multifunktionalität wie das optimale Entfernen von Schmutz, größtmögliche
Schonung des Gewebes so wie der Waschmaschine und Wasserenthärtung werden
vorrausgesetzt. Sie beinhalten deshalb eine Vielzahl an Stoffen, die jeweils
verschiedene Aufgaben zu erfüllen haben.
Die wichtigsten
Substanzen werden im Folgenden näher erklärt.
Tenside
- Anionische Tenside weisen in der Regel Carboxylat-, Sulfat-, Sulfonat- oder
Benzolsulfonat Gruppen im hydrophilen Teil des Tensids auf, welcher auch
negativ geladen ist. Daraus resultieren:
a)
Alkylcarboxylate (Seifen):
Seifen
sind die ältesten Wasch- und Reinigungsmittel, bringen jedoch einige Nachteile
mit sich:
Wässrige Seifenlösung ist
alkalisch, da Fettsäureanionen mit Wasser folgendermaßen reagieren:
Abb. 10.1:



Wässrige
Seifenlösungen können leicht einen pH-Wert von über 9 annehmen und greifen
dadurch viele Textilien und vor allem die Haut an. Zusätzlich wird durch
häufiges Händewaschen mit Seife das Fett aus der Haut gelöst und diese trocknet
aus.
Beim Waschen in hartem Wasser
verbinden sich die Calcium- oder Magnesiumionen mit den Seifenanionen zu
Kalkseife, welche ein schwerlösliches Salz ist.
Abb. 11.1:
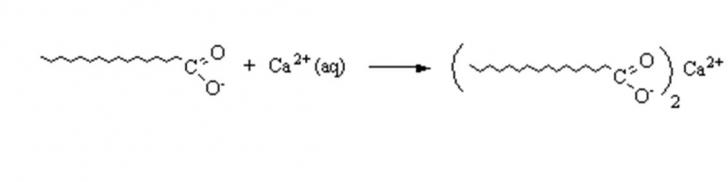
Hierbei
werden Seifenanionen verbraucht und die Waschwirkung der Seifenlösung geht
somit verloren. Durch Zusatz von einer genügend großen Menge an Seife kann zwar
die Waschwirkung wieder hergestellt werden, jedoch stellt dies einen
unwirtschaftlichen Verbrauch an Seife dar und belastet auch die Umwelt.
Außerdem
lagert sich Kalkseife auf den Gewebefasern ab, wo die Kristalle der Kalkseife
schließlich die Textilfasern zerschneiden. Das Gewebe vergraut, verfilzt und
wird brüchig.
In saurer Lösung bilden sich
unlösliche Fettsäuren:
Abb. 11.2:

Mit
Seife darf daher nie in saurem Wasser gewaschen werden.
b)
Alkylsulfate
(Fettalkoholsulfate = FAS):
Die
Alkyl- bzw. Fettalkoholsulfate sind Schwefelsäurehalbester von Fettalkoholen
und wurden bereits in den 30er Jahren in Feinwaschmitteln wie "Fewa"
eingesetzt. Sie werden auch heute noch verwendet.
c)
Alkansulfonate (AS):
Der
Unterschied zu den Alkylsulfaten liegt hier in einer veränderten Anordnung der
SO3 - Gruppe
d)
Alkylbenzolsulfonate (ABS):
Der
wichtigste Vertreter dieser Gruppe war bis zu den 60er Jahren das
Tetrapropylbenzolsulfonat (TPS). Es hatte in den 50er Jahren die Seife als
Tensid weitgehendst verdrängt. Jedoch fand man heraus, dass TPS im Abwasser nur
schlecht abgebaut wird und wurde deshalb ab 1964 durch Alkylbenzolsulfat (ABS)
abgelöst, welches seit Jahren das wichtigste Tensid in der Waschmittelchemie
ist.
- Bei den kationischen Tensiden
ist der hydrophile Teil des Tensides stickstoffhaltig und positiv geladen.
Wegen ihrer positiven Ladung nennt man sie auch Invertseifen.
In
der Waschmittelchemie werden kationische Tenside wegen ihrer Eigenschaft, sich
wie ein Film auf die Fasern zu legen und die Oberfläche dadurch glatter
erscheinen zu lassen, als Weichspüler verwendet Als waschaktive Substanz
spielen sie keine Rolle, da die Säuberungswirkung unausreichend ist und sie
sich außerdem mit anionischen Tensiden zu unlöslichen Salzen verbinden.
- Amphotere Tenside enthalten sowohl anionische wie auch kationische Gruppen im
hydrophilen Molekülteil und verhalten sich demnach je nach pH-Wert wie
Anion- oder Kationtenside. Sie sind unter anderem in Spezialwaschmitteln
von Wäscherein enthalten
- Bei den nichtionischen Tensiden (Niotensiden)
hat der hydrophile Molekülteil keine Ladung und enthält meist alkoholische
Hydroxydgruppen oder Polyether. Die stark elektronegativen Sauerstoffatome
tragen zur negativen Polarisierung des hydrophilen Teils bei, weshalb die
Eigenschaften der nichtionischen Tenside denen der anionischen Tenside
recht ähnlich sind.
Beispiele
für nichtionische Tenside sind Fettalkoholpolyglycolether (AEO),
Saccharosefettsäureester oder Alkylpolyglycoside (APG).
Niotenside
haben gegenüber anionischen Tensiden die Vorteile, dass sie:
weniger härtempfindlich als
anionische Tenside
hautfreundlicher
nicht toxisch
vollständig biologisch abbaubar
und aus nachwachsenden Rohstoffen
herstellbar
sind
und werden daher möglicherweise die anionischen Tenside in naher Zukunft vom
Markt verdrängen. Der einzige Nachteil liegt zur Zeit noch in den
verhältnismäßig hohen Produktionskosten.
Enthärter
Enthärter
sind ein wichtiger Bestandteil der Waschmittel, da diese Metallionen aus dem
Wasser und dem Schmutz "entfernen". Ihre Aufgaben sind:
Verhinderung von Gips- und
Kalkablagerungen
Verbesserung des Quellvermögens
von organischem Schmutz
Stabilisierung von Bleichmitteln
Zerstreuung (Dispergierung) von
Schmutz beruht jedoch weniger auf dem Entzug von Metallionen, als vielmehr auf
der Tatsache, dass sich negativ geladene Triphosphationen auf der Oberfläche
der Schmutzpartikel anlagern und sie somit negativ geladen sind. Sie stoßen
sich nun von anderen negativ geladenen Schmutzpartikeln sowie von negativ
geladenen oder polarisierten Oberflächen ab.)
Die
Wasserhärte
Wasser
enthält mehr oder weniger große Mengen an Calcium- und Magnesiumsalzen.
Hauptsächlich sind dies Carbonate und Sulfate. Daneben kommen auch noch andere
Salze vor, die allerdings bei der Wasserhärte nicht von Bedeutung sind.
Je
höher der Gehalt eines Wassers an Magnesiumcarbonaten und -sulfaten bzw.
Calciumcarbonaten und -sulfaten, desto härter ist das Wasser, je geringer die
Gehalte sind, desto weicher.
Man
unterscheidet die Carbonathärte (temporäre Härte), die durch die Konzentration
an Carbonationen (CO32-) bestimmt wird. Die Konzentration
an Sulfat- (SO42-) und anderen Salzionen wird mit der
permanenten Härte angegeben.
Carbonathärte
und permanente Härte bilden die Gesamthärte, welche bei uns in dGH (deutsche
Gesamthärte) gemessen wird. Die Angabe der Gesamthärte erfolgt in sdH.
Härtestufen dH:
0-4s dH: sehr weich
4-8s dH: weich
8-14s dH: mittelhart
14-30s dH: hart
>30s dH: sehr
hart
Die
Ablagerungen auf den Heizstäben sind auf die Bildung von schwerlöslichen
Metallcarbonaten, auch Kesselstein genannt, zurückzuführen.
In
hartem Wasser sind Hydrogencarbonationen enthalten, welche beim Erhitzen des
Wassers zusammen mit den Ca2+ bzw. Mg2+ -Ionen ein
schwerlösliches Salz (Kesselstein) bilden.
2 HCO3- + Ca2+ → CaCO3 + H2CO3
Die
Kohlensäure zerfällt in Kohlendioxid und Wasser.
Die
Ca2+ und Mg2+ -Ionen können aber auch, wie bereits im
Punkt Nachteile der Alkylcarboxylate erwähnt, mit der in Waschmitteln
enthaltenen Seife Kalkseife bilden. Diese lagert sich auf dem Gewebe an
und führt mit der Zeit zur Vergrauung und Verfilzung des Gewebes, da die
kristallförmige Struktur die Fasern "zerschneidet".
Moderne
Waschmittel enthalten daher die sogenannten Wasserenthärter.
Wasserenthärter binden die Ca2+ und Mg2+ -Ionen und
halten diese während des Waschvorganges in Lösung.
Nachfolgend
sind die wichtigsten phosphathältigen und phosphatfreien Enthärter angeführt:
Phosphathaltige Enthärter
Phosphate
sind starke Wasserenthärter bei allen gängigen Waschtemperaturen. Ihr großer
Nachteil ist der Düngereffekt der bei der Entsorgung eintritt. Durch die
phosphathaltigen Abwässer wurden die Seen überdüngt und es kam zur Eutrophierung:
Durch
die großen Mengen an Phosphaten setzt ein Massenwachstum von Algen ein, welche
das Wasser trüben, so dass nach einiger Zeit nur noch in der oberflächennahen
Schicht genügend Licht für die Photosynthese vorhanden ist. Die Algen in den
tieferen Schichten sterben ab und werden zersetzt. Diese Zersetzungsprozesse
verbrauchen jedoch große Mengen an Sauerstoff. Dies führt zu Fäulnis und
Bildung toxischer Stoffe, was wiederum das Sterben von Tieren und Fischen zur
Folge hat. Das Gewässer "kippt um".
Aus
diesem Grund wurde in vielen Ländern eine Phosphathöchstmengenordnung oder gar
ein Verbot erlassen.
Natriumtriphosphat:
Sein Vorteil ist die schnelle Bindung von Calcium-Ionen,
die den Hauptteil der Wasserhärte ausmachen. Natriumtriphosphat hat auch
dispergierende Eigenschaften und unterstützt damit den Reinigungsvorgang.
Außerdem ist es ungiftig. Der wesentliche Nachteil dieser Verbindung ist der
Düngereffekt, der zur Eutrophierung (siehe oben) von Gewässern führt.
Phosphonate:
Phosphonat
trägt zwar wie Natriumtriphosphat zur Eutrophierung bei, jedoch in deutlich
geringerem Maße, da es einen weitaus niedrigeren Phosphorgehalt und außerdem
eine etwa 3 mal so hohe Metallionenbindungskapazität hat.
Phosphatfreie Enthärter:
Alkylcarboxylat (Seife):
Alkylcarboxylat
bindet die Metallionen als unlösliche Fettsäuresalze und ist ein ungiftiger und
vollständig abbaubarer Wasserenthärter. Jedoch erfordert der Abbau von Seife
große Mengen an Sauerstoff.
Zeolith A (Sasil):
Zeolith
A ist ein Natriumaluminiumsilicat, dessen Handelsname "Sasil" aus dem
Englischen, von sodium aluminium
silicate, abgeleitet ist. Zeolith A ist ein Kristall mit Hohlräumen in
denen sich Natrium-Ionen befinden, welche beim Waschen durch die im Wasser
befindlichen Mg2+- und Ca2+ Ionen ausgetauscht werden.
Zeolith A ist daher ein Ionenaustauscher.
Abb. 15.1:
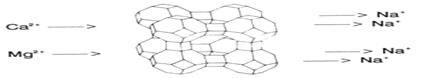
Wirkungsweise von Zeolith A (Ionenaustauscher)
Jedoch
setzt die enthärtende Wirkung nur langsam ein und es muss dem Waschmittel daher
noch ein schnell wirkender Enthärter (Coenthärter) hinzugefügt werden.
Zeolith
A ist nach heutigem Stand der umweltverträglichste Enthärter, da es
wasserunlöslich ist, aus dem Wasser gefiltert und zu Kieselsäure umgewandelt
werden kann.. Außerdem hat Zeolith A, im Gegensatz zu phosphathältigen
Enthärtern, keinen Düngereffekt und ist ungiftig.
Polycarboxylate:
Polycarboxylate
sind eine Gruppe von wasserlöslichen Polymeren, bei denen, beim Vorgang der
Wasserenthärter, jeweils 2 Ionen der Verbindung (z.B.Natriumionen) gegen 1
Magnesium- oder Calciumion ausgetauscht.
Abb. 15.2:
Natriumpolyacrylat
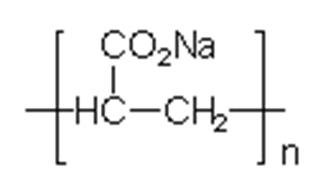
In
der Waschmittelindustrie werden Polycarboxylate oft in Verbindung mit Zeolith
A, auf Grund ihrer schnellen Wirkung bei der Wasserenthärtung, verwendet. Außerdem
sind sie auch als Carrier tätig. Als Carrier nehmen die Polycarboxylate
Mg2+- und Ca2+ -Ionen auf und geben diese an die
Zeolithen weiter.
Citrate:
Bei
einem Citrat handelt sich um ein Natriumsalz der Zitronensäure. Es fällt bei
niedrigen Temperaturen Calciumionen als Calciumcitrat aus (auch Mg2+).
Abb. 16.1:

Bei höheren Temperaturen nimmt die Bindungsfähigkeit
jedoch enorm ab.
Citrate sind vollkommen ungiftig und zu 100% biologisch
abbaubar.
EDTA:
EDTA
(Ethylendiamintetraacetat) ist ein schnell wirkender Enthärter der sehr stabile
Verbindungen mit Calcium-, sowie anderen Metallionen, eingehen kann. Dies kann
auch zur Folge haben, dass giftige Komplexe mit Schwermetallen gebildet werden,
die dann ins Wasser gelangen und in Klär- und Aufbereitungsanlagen gar nicht
oder nur schwer zurückgehalten werden können.
Abb. 17.1:
EDTA (Ethylendiamintetraacetat)
Tetranatriumsalz
|
|
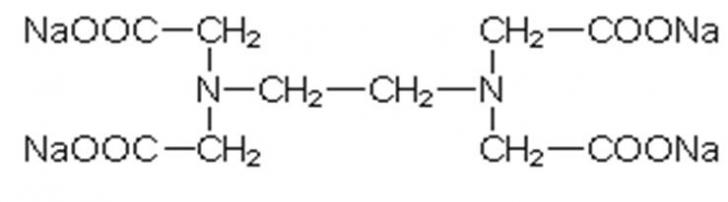
NTA:
NTA
(Nitrilotriacetat) ist ein stickstoffhaltiger, schnell wirkender Enthärter, der
wie EDTA starke Komplexe mit Metallionen, besonders mit Schwermetallen, bildet.
NTA kann jedoch in Kläranlagen bis zu 95% abgebaut werden.
NTA
fördert außerdem auch, wenn auch nur sehr schwach, die Eutrophierung von
Gewässern.
Abb. 17.1:
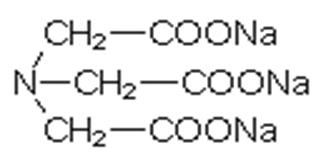
|
|
NTA (Nitrilotriacetat)
Trinatriumsalz
|
|
Die
zu verwende Enthärtermenge hängt davon ab, welcher Enthärter verwendet wird, da
jeder andere Kapazitäten bei der Mg2+ und Ca2+ Aufnahme hat. Die untenstehende
Tabelle soll die Möglichkeit zum Vergleich der verschiedenen Enthärter geben.
Tabelle 17.1:
|
Enthärter
|
20s
|
90s
|
|
Phosphonat
|
|
|
|
NTA
|
|
|
|
EDTA
|
|
|
|
Citrat
|
|
|
|
Zeolith
|
|
81 (60s)
|
|
Polycarboxylat
|
|
|
|
Triphosphat
|
|
|
|
Alkylcarboxylat
|
|
|
Bindungskapazitäten von Enthärtern in mg Ca2+
-Ionen / 1g Enthärter
Alkalien:
Dem
Waschmittel werden Alkalien hinzugefügt um einen hohen pH-Wert zu erhalten, der
zur besseren Schmutzentfernung beiträgt, da dadurch die Schmutzpartikel und die
Textilfasern stärker negativ aufgeladen werden und es somit zu einer stärkeren
elektrostatischen Abstoßung kommt.
Handelsübliche
Waschmittel erzielen durch den Zusatz von Soda (Na2CO3)
einen pH-Wert von 10-11. Höhere pH-Werte wären nicht sinnvoll, da ansonsten
Textilfasern und Enzyme zerstört werden würden. Außerdem stellt ein hoher
pH-Wert auch eine Gefahr für den Anwender da.
Soda
unterstützt darüber hinaus auch die wasserenthärtende Wirkung von Zeolithe und
wurde vor allem in den 50er Jahren als primärer Wasserenthärter verwendet. Die
entstehenden Erdalkalicarbonate lagern sich jedoch auf der Wäche ab. Daher
wurde der Anteil an Soda in Waschmitteln reduziert.
Enzyme:
Bei
bestimmten Molekülen ist der Einsatz von Tensiden unwirksam, deshalb enthalten
Waschmittel Enzyme, die z.B. eiweiß- oder stärkehaltigen Schmutz zu kleineren
und wasserlöslichen Bausteinen gespalten werden. Die häufigst verwendeten
Enzyme sind Proteasen, Amylasen, Lipasen und Cellulasen.
Proteasen:
Proteasen
sind die meist verwendeten Enzyme in Waschmitteln und werden zum Entfernen von eiweißhaltigen
Verschmutzungen, wie z.B. Blut-Milch- oder Eigelbflecken, verwendet.
Eiweiße (Proteine) sind hochmolekulare
Verbindungen, die aus Aminosäuren aufgebaut sind. Charakteristisches Merkmal
der Eiweiße ist ihre Peptidbindung (-CO-NH-),
die bei der Verknüpfung zweier Aminosäuren zustande kommt.
Proteasen
bauen Eiweiße durch die Spaltung der Peptidbindung in wasserlösliche Bestandteile
ab.
Abb 18.1:
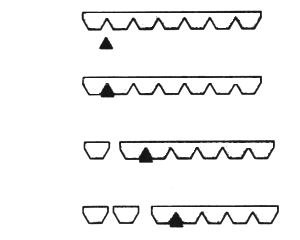
Spaltung der Eiweiße in kleinere, wasserlösliche Teile
Das
Enzym wird bei der Spaltung der Proteine nicht verbraucht, daher reichen schon
kleine Mengen an Enzymen um große Mengen an Eiweißen zu spalten, jedoch dauert
der Vorgang umso länger, je weniger Enzyme eingesetzt werden.
Die
Wirkung von Enzymen ist aber auch von der Temperatur und vom pH-Wert der sie
umgebenden Flüssigkeit abhängig. Proteasen sind zwischen 20sC und 65sC aktiv
und entfalten ihre volle Wirkung bei 60sC. Es gibt jedoch auch schon Enzyme die
bis 95sC aktiv sind.
Der
pH-Wert sollte bei den meisten Enzymen zwischen 9 und 11 liegen. Nur wenige Enzyme
sind in ihrer Wirkung kaum pH abhängig.
Amylasen:
Amylasen
bauen kohlenhydrathaltige Verschmutzen (Gras-, Schokoladeflecken) zu löslichen
Sacchariden ab.
Lipasen:
Lipasen
sind in der Lage Fett zu spalten, weisen aber gegenüber Tensiden lediglich bei
Zimmertemperatur Vorteile auf. Kombipräparate aus Lipasen und Tensiden erhöhen
daher die Waschwirkung - die Lipasen lösen die Fettverschmutzung leicht an und
erleichtern damit den Tensiden die Schmutzablösung.
Cellulasen:
Cellulasen
können von Baumwoll- und Cellulosefasern abstehende
Cellulosemikrofibrillenbündel (Baumwollfussel) entfernen. Dadurch wird
einerseits der optische Eindruck der Oberfläche verändert (verhindern von
Verblassung oder Farbtrübung des Gewebes), andererseits führt dies indirekt zu
einer verbesserten Schmutzablösung, da beim Ablösen der
Cellulosemikrofibrillenbündel der darauf haftende Schmutz mit entfernt wird.
Bleichmittel:
Viele
Farbstoffflecken (z.B. Tinte, Rotwein, Kosmetika) kann man nicht mit Tensiden
entfernen, da sie zu stark an den Textilfasern haften. Beim Bleichen wird der
Schmutz durch chemische Umwandlung, vor allem durch Oxidation, zerstört. Dabei
wird der farbige Schmutz in farblose Verbindungen umgewandelt, die meist sogar
wasserlöslich sind und deshalb leicht entfernt werden können. Bleichmittel
sollten jedoch nicht in Feinwaschmitteln vorhanden sein, da sie auch
Textilfarbstoffe zerstören.
Natriumhypochlorit (Chlorbleiche):
Die
Bleichung mit Natriumhypochlorit (NaOCl), auch "Chlorbleichung" genannt, beruht
auf der Freisetzung von nascierendem (besonders reaktionsfähig im
Augenblick der Entstehung) Sauerstoff [O].
OCl- + H2O HOCl + OH-
HOCl + OH- Cl + H2O + [O]
Die
Chlorbleiche hat die Vorteile, dass die Bleichwirkung schon bei Raumtemperatur
einsetzt und sie neben der Bleichwirkung auch noch antibakteriell wirkt. Jedoch
wird sie trotz der genannten Vorteile und der wenig umweltbelastenden
Zerfallsprodukte (Cholridionen, Sauerstoff und Wasser) kaum mehr verwendet. Hierfür
gibt es mehrere Gründe:
Die Chlorbleiche kann durch
Nebenreaktionen giftige Chlorverbindungen erzeugen
Greift Fasern stärker an als
andere Bleichmittel
Bei langer Lagerung zerfällt
Natriumhypochlorit zu Kochsalz und Natriumchlorat (NaClO3). Natriumchlorat ist ein Oxidationsmittel, das
bei Kontakt mit organischen Materialien zu Explosionen führen kann. Außerdem
ist es im Unkrautvernichtungsmittel "Unkraut-Ex" der wirkende Bestandteil.
Beim mischen von Hypochlorit mit
Säuren wird das hochgiftige Chlorgas freigesetzt und stellt daher im Haushalt
ein erhebliches Unfallrisiko dar.
NaOCl + 2 HCl Cl2 +
NaCl + H2O
Perborat:
Die
bleichende Wirkung von Perborat, welche ab einer Temperatur von 60sC einsetzt,
beruht auf der Bildung von Wasserstoffperoxid (H2O2):

Na2B2H4O6 + 2 H2O 2 H2O2 + 2 Na+ + 2 H2BO3-
Im
alkalischen Milieu reagiert Wasserstoffperoxid zu Wasser und Perhydroxyl-Ionen.
Die Perhydroxyl-Ionen und der aus ihrem Zerfall entstehende nascierende
Sauerstoff sind die Oxidationsmittel.

H2O2 + OH- H2O + HO2-
 HO2- OH- + [O]
HO2- OH- + [O]
Der
Nachteil an Perborat ist, wie schon oben erwähnt, dass die bleichende Wirkung
und somit die Bildung von atomarem Sauerstoff erst ab einer Temperatur von ca.
60sC einsetzt. Um mit Perborat jedoch auch bei niedrigeren Temperaturen
bleichen zu können, müssen Aktivatoren eingesetzt werden, die den Zerfall
katalysieren. Hierzu werden TAED (Tetraacetylethylendiamin) und TAGU
(Tetraacetylglykoluril) eingesetzt. Diese bilden in alkalischen Lösung auch
schon bei unter 60sC eine bleichaktive Verbindung, die Peroxoessigsäure.
Abb. 20.1:
TAED
(Tetraacetylethylendiamin)
|
|

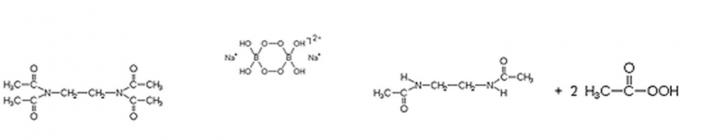
Peroxosäuren
zerfallen bereits bei Raumtemperatur zu Essigsäure und nascierendem Sauerstoff.
Abb. 21.1:
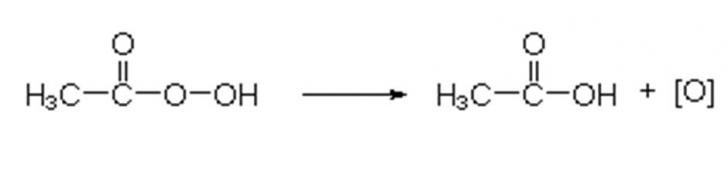
Vergleich der
Bleichmittel:
Die bleichende
Wirkung von Chlorbleiche setzt zwar schon bei Zimmertemperatur ein, jedoch ist
Natriumhypochlorit für die Umwelt belastend und nicht ungefährlich.
Perborat hat den
entscheidenden Nachteil, dass seine Bleichwirkung erst bei 60sC einsetzt und
somit Aktivatoren von Nöten sind um auch bei niedrigeren Temperaturen zu
bleichen.
Die
Umweltschädlichkeit von Perborat ist bedenklich, weil Borverbindungen in
Kläranlagen nicht zurückgehalten werden.
Die
umweltfreundlichen Bleichmittel, wie reines H2O2 oder Peroxosäure, haben jedoch allesamt einen
Anwendungstechnischen Nachteil. So sind H2O2 und
Peroxosäure stark ätzende Stoffe und daher für den Haushalt aufgrund der von
den Stoffen ausgehenden Gefahr nicht geeignet.
Optische
Aufheller:
Optische
Aufheller haben keine bleichende oder reinigende Wirkung. Es sind Farbstoffe,
die beim Waschen die Fasern überziehen. Sie wandeln die unsichtbaren
UV-Strahlen des Tageslichts in sichtbares Licht um. Mit optischem Aufheller
gewaschenes Gewebe strahlt einen höheren Blauanteil des Lichts zurück.
Der Weißeindruck
ist für den Menschen stärker, wenn das zurückgeworfene Licht einen höheren
Blauanteil hat.
Wäsche erhält
nach häufigem Waschen einen Gelbstich. Durch den optischen Aufheller wird aber
der Blauanteil des zurückgestrahlten Lichts erhöht und die Wäsche erscheint dem
Menschen weißer,
Ungünstig können
optische Aufheller auf pastellfarbene Textilien wirken. Sie können deutliche
Farbveränderungen hervorrufen. Auch wenig kräftig gefärbte Textilien können
verblassen. Aus Schwarz kann dann z.B. Anthrazit werden. Ein weiterer Nachteil
optischer Aufheller ist, dass bei empfindlichen Personen Hautreizungen bzw.
Hauterkrankungen auftreten können. Weiterhin nachteilig ist die eingesetzte
Menge an Weißtönern, da sie biologische schwer abbaubar sind.
Schaumregulatoren
(Schauminhibitoren):
Die
in Waschmitteln enthaltenen Tenside wirken schaumbildend Schaum ist eine
Mischung aus Gas und Flüssigkeit und hilft auf Grund ihrer großen
Flüssigkeitsoberfläche beim Transport von Schmutz, da sich dieser auf der
Oberfläche anlagert. Zu viel Schaum mindert jedoch die Waschleistung da Schaum
keinen Schmutz lösen kann. Schauminhibitoren sollen daher verhindern, dass es zu einer Überschäumung kommt.
Als
Schaumregulatoren werden meist Seifen mit 20-22 C-Atomen im hydrophoben Teil
verwendet. Sie lagern sich auf den Schaumlamellen an und mindern ihre
Filmelastizität. Dadurch brechen die Schaumlamellen und die Größe der
Schaumblasen verringert sich.
Vergrauungshemmer
(Vergrauungsinhibitoren):
Vergrauungsihnhibitoren
verhindern die Wiederanlagerung von sich in der Waschlauge befindlichem bereits
gelöstem Schmutz auf der Wäsche. Eine
Wiederanlagerung von Schmutz würde zu einer Vergrauung der Wäsche führen.
Vergrauungsinhibitoren
legen sich auf Grund der ähnlichen Struktur an den Fasern an und verhindern somit
ein erneutes Verbinden des Schmutzes mit der Wäsche. Der Nachteil jedoch ist,
dass man für unterschiedliche Faserarten und Faserverarbeitungen
unterschiedliche Vergrauungsinhibitoren benötigt.
Der
am Häufigsten für Baumwolle und ähnliche
Fasern verwendete Vergrauungshemmer ist CMC (Carboxymethylcellulose). Für
synthetische Fasern werden hauptsächliche Ether und Alkohole verwendet.
Verfärbungshemmer
(Verfärbungsinhibitoren):
Textilien
können beim Waschen ausfärben und andere Textilien verfärben. Aus diesem Grund
enthalten Colorwaschmittel Verfärbungsinhibitoren, das sind Stoffe, die im
begrenzten Rahmen Farbstoffmoleküle binden können.
Als
Verfärbungsinhibitor in Waschmitteln wird häufig PVP (Polyvinylpyrrolidon)
verwendet. PVP ist ein langkettiges Molekül, das die Farbstoffmoleküle
umschließt.
Dabei ragen die hydrophilen Molekülteile des PVP in Richtung Wasser. Der
Farbstoff wird dadurch im Waschwasser gehalten und ein Kontakt zwischen
Textilien und Farbstoff verhindert. PVP ist hauptsächlich wirksam bei Baumwolle
und Leinen, bei Wolle und Polyamidfasern ist es weniger effektiv.
Weichspüler
Textilen
werden mit der zeit rauer, da die Fasern mit der Zeit beschädigt werden und
sich außerdem Kalk ablagern kann.
Die
Kalkablagerungen können durch Zugabe von Zitronen- oder Essigsäure in das
Spülwasser gelöst werden. Bei Cellulosemikrofibrillenbündel und beschädigte
Fasern ist es möglich, diese durch Enzyme wie Cellulasen abzubauen.
Als
Weichspüler werden jedoch kationische Tenside genannt, die sich direkt an die
negativ polarisierten Sauerstoffatome der Textiloberfläche anlagern. Die
hydrophoben Molekülreste ragen dabei nach außen.
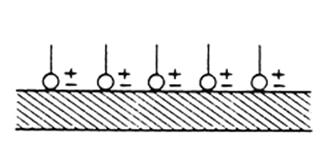
Abb 23.1:
Anlagerung von kationischen Tensiden an Textilien
Duftstoffe:
Den
Waschmitteln werden meist noch Duftstoffe zugesetzt um die unangenehme
Waschlaugengerüche zu überdecken und um die Wäsche frischer duften zu lassen.
Quellen:
https://www.educeth.ch/chemie/puzzles/seifen
https://dc2.uni-bielefeld.de/dc2/haus/tenside.htm
https://www.medizinfo.com/hautundhaar/haar/tenside.htm
https://www.muenster.org/kantgym/s2/02-f-arb/bi-sr-as.pdf
https://matsci.iw.uni-halle.de/Kressler/Lehre/PraktPhysMeth/OFS-2.pdf
https://www.fh-niederrhein.de/~gfmeyers/chemie/chemie79.htm
(https://www-vt.uni-paderborn.de/verf/woehler/Veroeff1.pdf)
Bildquellen:
Abb. 8.1: https://www.uni-essen.de/chemiedidaktik/S+WM/Wirkung/WasstrGewTensid.jpg
Abb. 9.1: https://www.chemieunterricht.de/dc2/wsu-haush/images/s62a.gif
Abb. 9.2: https://www.chemieunterricht.de/dc2/wsu-haush/images/s62b.gif
Abb. 9.3: https://www.chemieunterricht.de/dc2/wsu-haush/images/s62c.gif
Abb. 15.1: https://www.chemieunterricht.de/dc2/wsu-haush/images/abb7.gif