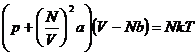Das Verhalten realer
Gase -
Modellbildung , Grenzen und Kurvendiskussion
Facharbeit
1. Einleitung
Für die Behandlung des Verhaltens realer Gase ist es
hilfreich , sich zunächst mit den Grundlagen der Theorie der sogenannten
idealen Gase vertraut zu machen . Dadurch , daß kein Gas exakt den Gesetzen der
idealen Gase folgt , ergibt sich erst die Notwendigkeit , sich mit realen Gasen
genauer zu beschäftigen und eigene Gesetzmäßigkeiten für sie zu entwickeln .
Bei der Betrachtung eines idealen Gases wird außer Acht gelassen , daß die
Gasmoleküle ein Eigenvolumen besitzen , welches das Gesamtvolumen des Gases ,
wenn zunächst auch nur geringfügig , beeinflußt . Ebenso wird z.B. nicht
berücksichtigt , daß im Gas intermolekulare Wechselwirkungen ( Anziehungskräfte ) herrschen , die das Verhalten des
Gases im geschlossenen Raum beeinflussen . Da Meßergebnisse durch diese Faktoren unter normalen Bedingungen nicht
sehr stark beeinflußt werden , genügt es häufig , das Verhalten realer Gase
über die Gleichungen der idealen Gase zu bestimmen und die entstehenden Fehler
nicht zu berücksichtigen . Die Fehler , die hierbei auftreten , werden zudem mit kleiner werdendem Druck und
steigender Temperatur , also mit zunehmender Verdünnung des Gases , zunehmend
kleiner . Für genauere Ergebnisse , die
reale Gase betreffen , bedarf es aber einiger verbesserter Zustandsgleichungen
, die die oben genannten Faktoren ( Eigenvolumen etc. ) berücksichtigen . Im
nächsten Kapitel soll zunächst aber nur das Verhalten der idealen Gase (
eigentl. "das ideale Gas" , da es nur das eine , theoretische Modell gibt
)beschrieben werden.
Im dritten Kapitel werden dann die realen Gase mit
ihren Zustandsgleichungen beschrieben . Sollte hier nichts anderes erwähnt sein
, gelten alle Gleichungen und Aussagen für jeweils ein mol des Gases , da dies
die zur Berechnung am häufigsten benutzte Gasmenge ist .
Ideale
Gase
Geht man , laut dem Gesetz von
GAY-LUSSAC , von einer bestimmten Gasmenge aus , die bei einem bestimmten Druck
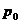 und einer Temperatur
und einer Temperatur 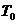 das Volumen
das Volumen 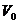 hat und erwärmt diese
Gasmenge bei gleichbleibendem Druck auf eine beliebige Temperatur T , so gilt
für das neue Volumen
hat und erwärmt diese
Gasmenge bei gleichbleibendem Druck auf eine beliebige Temperatur T , so gilt
für das neue Volumen 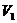 des Gases die
Gleichung :
des Gases die
Gleichung :
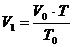 (a)
(a)
Nun kann man nach dem BOYLE-MARIOTTEschen Gesetz die
Volumenänderung von 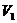 auf V bei konstant
gehaltener Temperatur durch Anderung des Druckes von
auf V bei konstant
gehaltener Temperatur durch Anderung des Druckes von 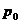 auf den Druck p
berechnen . Hier gilt für das neue Volumen V :
auf den Druck p
berechnen . Hier gilt für das neue Volumen V :
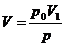
oder : 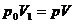 (b)
(b)
Nun setzt man in Gleichung (b) 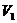 aus Gleichung (a) ein
und erhält so folgende Gleichung :
aus Gleichung (a) ein
und erhält so folgende Gleichung :
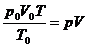 (c)
(c)
Eine Division durch T ergibt dann :
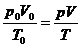 (d)
(d)
Diese Gleichung (d) sagt aus , daß der Term 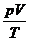 für ein ideales Gas
immer konstant ist , sich also auch berechnen läßt , da der Wert bei den
Ausgangsbedingungen der gleiche ist wie bei beliebigen Endwerten . Diese Konstante hat , je nachdem , welche
Einheiten man für Druck ,
für ein ideales Gas
immer konstant ist , sich also auch berechnen läßt , da der Wert bei den
Ausgangsbedingungen der gleiche ist wie bei beliebigen Endwerten . Diese Konstante hat , je nachdem , welche
Einheiten man für Druck ,
Temperatur und Volumen verwendet , verschiedene Werte
.
Diese Konstante wächst, bei gleichem Druck , Volumen
und Temperatur , proportional mit der Teilchenzahl .
Bei 1 atm Druck , 0°C und dem daraus resultierenden
Molvolumen von 22,414 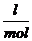 ergibt sich dann als universelle
Gaskonstante R folgender Wert :
ergibt sich dann als universelle
Gaskonstante R folgender Wert :
R =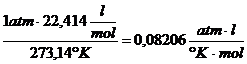
(siehe auch : BRDIČKA
: Grundlagen der physikal. Chemie , S.196)
Also ergibt sich aus der Gleichung
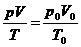 , daß
, daß 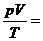 R sein muß . Aus
dieser Gleichung ergibt sich dann die absolut zentrale ideale
Zustandsgleichung (für ein mol Gas ) :
R sein muß . Aus
dieser Gleichung ergibt sich dann die absolut zentrale ideale
Zustandsgleichung (für ein mol Gas ) :
pV=RT
Für n mole Gas wäre entsprechend :
pV=nRT
In den allermeisten Fällen gehen alle anderen Gleichung von
dieser Tatsache , daß der Druck multipliziert mit dem Volumen gleich der
Temperatur multipliziert mit einer Konstanten ( und gegebenenfalls mal die
Anzahl der mole ) ist , aus , oder werden von ihr abgeleitet - auch die meisten
Gleichungen der realen Gase , wie wir noch sehen werden .

2.1. Das Verhalten idealer Gase
Die Gleichung 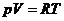 , nach p aufgelöst ,
ergibt nun die Funktion
, nach p aufgelöst ,
ergibt nun die Funktion
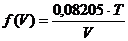 , (e)
, (e)
die bei jeweils konstanter Temperatur und für ein mol
ideales Gas , ein p-V-Diagramm mit folgenden Graphen ergibt :
Die Graphen dieser Funktion haben alle einen zweiten
Arm , der genau symmetrisch zur y-Achse verläuft . Dieser läßt sich hier jedoch
vernachlässigen , da diese Funktionswerte ein negatives Volumen voraussetzen
würden , was physikalisch unmöglich ist .
Deutlich zu sehen ist hier , daß sämtliche Graphen
streng monoton fallend sind , was auch die Ableitung zeigt . Sie lautet :
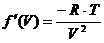 (f)
(f)
Sie ist im gesamten Bereich 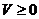 negativ , da der
Zähler hier immer negativ und der Nenner
immer positiv ist . Diese Graphen sind auch anschaulich logisch zu erklären ,
da sich mit steigendem Druck von außen das Volumen stetig verkleinern muß .
negativ , da der
Zähler hier immer negativ und der Nenner
immer positiv ist . Diese Graphen sind auch anschaulich logisch zu erklären ,
da sich mit steigendem Druck von außen das Volumen stetig verkleinern muß .
Diese Graphen zeigen auch , daß sich ein ideales Gas nicht
verflüssigen läßt , bei keinem beliebig hohen Druck und keiner beliebig
niedrigen Temperatur ! Eine Verflüssigung würde nämlich bedeuten , daß der
Graph bei einem bestimmten Druck waagerecht zur x-Achse laufen müßte , das Volumen
also bei gleichbleibendem Druck stark verringert würde , was in der Realität
Meßergebnisse zeigen würden . Wenn die Ableitung (f) jedoch keine Nullstelle hat , ist die
Ausgangsfunktion streng monoton fallend :
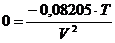 (g)
(g)
Gleichung (g) hat nur eine Lösung für T=0 , hier wäre
der Druck aber 0 für alle Volumina , was physikalisch unmöglich ist . Für alle
Temperaturen über 0°K ergibt sich jedoch keine Lösung für diese Gleichung (g) .
Sie zeigt für Temperaturen über 0°K obige Kurvenschar , deren Kurven keine
Nullstelle haben , was heißt , daß die Ausgangskurven tatsächlich streng
monoton fallend sind , da hier für alle Temperaturen (ausgenommen 0°K)
der Monotoniesatz gilt , der besagt , daß eine
Funktion f(x) streng monoton fallend ist , wenn für alle x gilt : 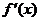 <0 , was hier zutrifft .
<0 , was hier zutrifft .
Eine Verflüssigung kommt durch die Anziehungskräfte der
Moleküle untereinander zustande .Da diese , wie schon in der Einleitung erwähnt
, bei idealen Gasen jedoch nicht berücksichtigt werden , ließe sich ein ideales
Gas also nicht verflüssigen - es wäre , da die Moleküle eines idealen Gases
kein Eigenvolumen besitzen , unendlich weit kompressibel, bis zu einem Volumen
von 0 . Da sich aber jedes Gas , nötigenfalls bei
sehr hohen Drücken und / oder sehr tiefen Temperaturen
, verflüssigen
läßt , und auch kein Gas das Volumen 0 einnehmen kann , tritt bei den Gleichungen der idealen Gase zur
Beschreibung der realen Gase offensichtlich ein Fehler auf , der besonders schwerwiegend
ist , wenn man nun den Vorgang des Verflüssigens von Gasen berechnen möchte .
Um das Eigenvolumen , die Wechselwirkungen u.s.w. zu berücksichtigen ,
bedürfen die Zustandsgleichungen der idealen Gase
anscheinend einiger Korrekturen .
3. Reale Gase
Im 19. Jahrhundert haben sich viele Wissenschaftler
mit dem Verhalten von Gasen und besonders mit dem Vorgang des Verflüssigens
beschäftigt . Hierbei haben sie festgestellt , daß die experimentell
ermittelten Kurven nicht ganz den Kurven der idealen Gase folgen , sondern von
ihnen abweichen . Dies ist besonders stark in dem Bereich der Kurve zu sehen ,
in dem sich das Gas verflüssigt . Da die Zustandsgleichungen der idealen Gase
keine Verflüssigung vorsehen , mußten sie korrigiert werden . In den
Gleichungen mußten das Eigenvolumen der Gasmoleküle sowie die intermolekularen
Wechselwirkungen berücksichtigt werden , um reale Gase besser zu beschreiben . J.
van der Waals hat die wohl bekannteste Gleichung , die wohl auch am
häufigsten benutzt wird , aufgestellt . Er hat die ideale
Zustandsgleichung 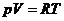 ( für 1 mol Gas )
folgendermaßen korrigiert :
( für 1 mol Gas )
folgendermaßen korrigiert :
Er subtrahierte vom Volumen V einen Teil b , der
inkompressibel ist , also das Eigenvolumen der Gasmoleküle darstellt .
Zusätzlich addierte er zum Druck p den sogenannten Binnendruck , der im Gas
herrscht . Dieser Teil stellt die Anziehungskräfte zwischen den Molekülen dar .
Prallen Moleküle an eine Wand , so überwiegen die Anziehungskräfte der Moleküle
, die nach innen wirken . Diese Kraft ist proportional der Anzahl der
Moleküle in der Volumeneinheit des Gases bzw. seiner Dichte . Die Anzahl der
Moleküle in der Grenzfläche ist ihrerseits jedoch auch der Dichte des Gases
proportional , so daß der resultierende innere Druck proportional dem Quadrat
der Dichte oder umgekehrt proportional dem Quadrat des Molvolumens ist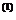 . So ergibt sich die zentrale Zustandsgleichung der realen
Gase , die van-der-Waalssche Gleichung (
hier für 1 mol ) :
. So ergibt sich die zentrale Zustandsgleichung der realen
Gase , die van-der-Waalssche Gleichung (
hier für 1 mol ) :
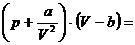 RT (h)
RT (h)
Der Proportionalitätsfaktor a , der für die Anziehungskräfte
steht , und der Wert b sind für jedes Gas unterschiedliche Werte ,
wobei b nach van der Waals gleich dem vierfachen des Eigenvolumens der Moleküle
ist .
3.1. Das Verhalten realer Gase
Diese Zustandsgleichung (h) nach p aufgelöst ergibt die
Gleichung
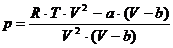 , (i)
, (i)
die als Funktion 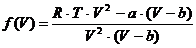 folgende Kurven ergibt
, bei denen die Temperatur jeweils konstant gehalten wurde und für a und b die
idealen Werte für Wasser , nämlich a=5,58 und b=0,031 und R=0,08206 eingesetzt
wurden , die in entsprechenden Einheiten angegeben werden müssen , damit sie in
der Gleichung angewandt werden können .
folgende Kurven ergibt
, bei denen die Temperatur jeweils konstant gehalten wurde und für a und b die
idealen Werte für Wasser , nämlich a=5,58 und b=0,031 und R=0,08206 eingesetzt
wurden , die in entsprechenden Einheiten angegeben werden müssen , damit sie in
der Gleichung angewandt werden können .
In folgender Tabelle sind die Parameter für einige Stoffe
angegeben :
Stoff a ( 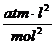 ) b (
) b ( 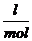 )
)
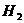 0,192 0,022
0,192 0,022
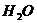 5,58 0,031
5,58 0,031
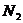 1,37 0,039
1,37 0,039
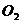 1,38 0,032
1,38 0,032
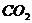 3,67 0,043
3,67 0,043
( aus : Greiner,Neise,Stöcker : Thermodyn. und Statist.
Mathem . ; S.20 )
Deutlich zu sehen ist bei Kurven unter 647°K , daß sie ein
lokales Minimum sowie ein lokales Maximum und zwei Wendepunkte haben . Hier
erhält man für einen Druck drei Werte für das Molvolumen . Oberhalb dieser
Temperatur erhält man nur einen reellen Wert ( hyperbelartiger Verlauf ) .
Unterhalb von 647°K sind es jedoch Kurven 3. Ordnung . Hier lassen sich auch ,
sofern vorhanden , die Nullstellen der Funktion berechnen . Der Bereich
zwischen den Nullstellen ist physikalisch gesehen völlig irreal , da hier der
Druck negativ wäre . Das bedeutet , hier wäre der Binnendruck a zu groß . Das gilt z.B. für Wasser bei der
Temperatur 473°K im Intervall 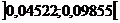 , da die Nullstellen der Funktion hier liegen :
, da die Nullstellen der Funktion hier liegen :
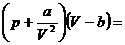 RT
RT
nach p aufgelöst mit a=5,58 , b=0,031 , R=0,08205
und T=473°K und gleich null gesetzt :
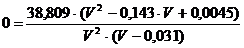 (j)
(j)
Nullstellen :
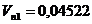
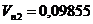
Außerdem haben die Kurven unterhalb von 647°K einen Abschnitt
zwischen den lokalen Extrema , in dem der Graph steigt . Das bedeutet , daß
hier mit abnehmendem Druck auch das Volumen kleiner wird , das Gas verdichtet
sich selbständig , was zunächst unmöglich erscheint . In diesem Bereich findet
jedoch die Verflüssigung des Gases statt , die Anziehungskräfte der Moleküle
ziehen das Gas sozusagen zusammen .
Oberhalb der 647°K gibt es diese Extrema nicht mehr , das
heißt , das Gas kann nicht verflüssigt werden , auch nicht bei dem größten Druck
oder dem kleinsten Volumen . Die Temperatur , oberhalb der es nicht mehr
möglich ist , ein Gas zu verflüssigen , nennt man Boyle -Temperatur oder
auch , seltener , kritische Temperatur . Sie beträgt z.B. bei Wasser 647°K oder
374°C .
Um nun den Bereich auf dem Graphen zu bestimmen , in dem die
Verflüssigung stattfindet , muß durch einen Punkt auf dem Graphen ,
der zwischen dem Minimum und dem Maximum liegt , eine Gerade
,
die parallel zur x-Achse läuft , gezogen werden . Die beiden
Flächen zwischen der Geraden und dem Graphen , die über dem Minimum bzw. unter
dem Maximum liegen , müssen zusätzlich exakt gleich groß sein .
Diese Gerade schneidet den Graphen dreimal , nämlich einmal
links des Minimums , zwischen den Extrema und rechts des Maximums . Die
Schnittpunkte der Geraden mit dem Graphen links und rechts der lokalen Extrema
zeigen nun die Grenzen des Phasenüberganges an . Erhöht man den Druck , beginnt
das Gas beim Schnittpunkt rechts des Maximums , sich zu verflüssigen und ist beim
Schnittpunkt links des Minimums vollständig verflüssigt . Ab hier ist die
Steigung der Kurve viel stärker negativ , was bedeutet , daß auch große
Druckerhöhungen nur kleine Volumenverkleinerungen bewirken , was auch
anschaulich logisch ist , da sich eine Flüssigkeit schwieriger komprimieren
läßt als ein Gas .
Die Gerade zeigt auch den Verlauf der Kurve an , die
experimentell ermittelt werden würde , da hier das Volumen bei einem bestimmten
Druck plötzlich kleiner wird ohne , daß der Druck weiter erhöht wird .
Im Experiment kann es auch den Bereich , in dem mit
steigendem Druck das Volumen größer wird ( zwischen den Extrema ) , nicht geben
.
3.2. Berechnung der Konstanten
Der Druck , der bei der kritischen Temperatur 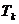 ( Boyle-Temperatur )
( Boyle-Temperatur )
aufgewendet werden muß , um das Gas zu verflüssigen , wird
der kritische Druck 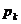 genannt . Das Volumen
des Gases bei der kritischen Temperatur und dem kritischen Druck ist das
kritische Volumen
genannt . Das Volumen
des Gases bei der kritischen Temperatur und dem kritischen Druck ist das
kritische Volumen 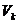
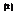 . Sie können experimentell bestimmt werden oder auch
rechnerisch , wie im folgenden gezeigt wird . Die kritischen Werte eines Gases
hängen nämlich mit den Konstanten a und b der van-der-Waals - Gleichung
zusammen . Um sie zu berechnen , benötigt man die van-der-Waalssche Gleichung
für den kritischen Zustand eines Gases , die lautet :
. Sie können experimentell bestimmt werden oder auch
rechnerisch , wie im folgenden gezeigt wird . Die kritischen Werte eines Gases
hängen nämlich mit den Konstanten a und b der van-der-Waals - Gleichung
zusammen . Um sie zu berechnen , benötigt man die van-der-Waalssche Gleichung
für den kritischen Zustand eines Gases , die lautet :
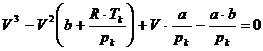 (k)
(k)
Aus der Tatsache , daß im kritischen Punkt alle drei Wurzeln
der kubischen Gleichung für V gleich dem kritischen Volumen 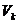 sind , folgt
sind , folgt
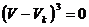
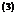
 (l)
(l)
Diese Gleichung (l) ausmultipliziert ergibt nun :
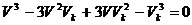 (m)
(m)
Jetzt können die Koeffizienten der Gleichungen (k) und (m)
miteinander verglichen werden , und man erhält :
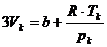 ;
; 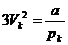 ;
; 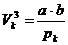 (n)
(n)
Hieraus ergibt sich :
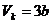 (o)
(o)
Jetzt kann man in (n) einsetzen :
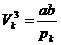
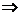
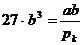 (p)
(p)
Multipliziert mit 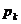 und dann dividiert
durch
und dann dividiert
durch 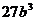 :
:
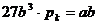
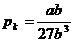
Gekürzt ergibt sich dann für 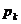 :
:
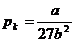 (q)
(q)
Jetzt setzt man die Gleichungen (o) und (r) in
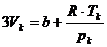 ein
ein
und kann so 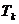 folgendermaßen
bestimmen :
folgendermaßen
bestimmen :
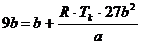 (r)
(r)
Division durch 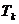 :
:
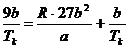 (s)
(s)
Division durch 9b :
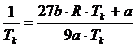 (t)
(t)
Durch Kürzen erhalten wir jetzt :
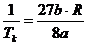 oder
oder 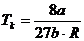 (u)
(u)
Also erhalten wir zusammengefaßt folgende Definitionen der
kritischen Werte eines realen Gases mit Hilfe der van-der-Waalsschen Konstanten
a und b :
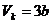 ;
; 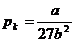 ;
; 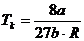
Man kann umgekehrt auch die van-der-Waalsschen Konstanten
über die kritischen Konstanten bestimmen , die experimentell bestimmt werden
können . Folglich können die Konstanten a und b , sowie die universelle
Gaskonstante R auch auf experimentellem Wege bestimmt werden :
Durch Umformung von 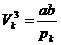 ergibt sich :
ergibt sich :
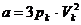
Ebenso durch Umformung ergibt sich aus 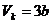 :
:
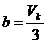
Die Gaskonstante R ergibt sich wie folgt :
In 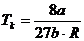 setzen wir für a und b
die oben ermittelten Werte ein :
setzen wir für a und b
die oben ermittelten Werte ein :
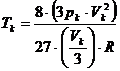 (v)
(v)
Die Klammern aufgelöst ergibt und mit R multipliziert
ergibt :
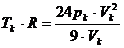 (w)
(w)
Durch 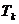 geteilt und gekürzt
ergibt schließlich :
geteilt und gekürzt
ergibt schließlich :
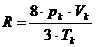 (x)
(x)
(siehe auch zu 3.2. : BRDIÇKA ;
Grundlagen der physikal. Chemie , S.253 f.)
3.3. Weitere
Zustandsgleichungen
Eine weitere häufig benutzte Zustandsgleichung zur
Beschreibung des Verhaltens realer Gase ist die CLAUSIUSsche Virialgleichung .
Sie ist im Prinzip ebenfalls eine erweiterte Zustandsgleichung der idealen Gase
. Sie lautet :
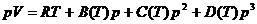 .
.
Die Koeffizienten B,C,D nennt man Virialkoeffizienten ,
die für jedes Gas unterschiedlich sind . Sie sind von der Temperatur abhängig .
Zur Vereinfachung wird häufig beim linearen Term abgebrochen :

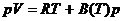
Wird die Zustandsgleichung nicht nach dem Druck , sondern
nach der Dichte entwickelt , sieht die Virialentwicklung folgendermaßen aus :
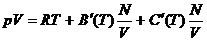
(aus : Greiner , Neise ,
Stöcker : Thermodynamik und statistische Mechanik , S.18)
Natürlich können alle Gleichungen auch für eine beliebige
Teilchenzahl und nicht unbedingt für ein mol Gas aufgestellt werden , am
häufigsten wird jedoch diese Menge betrachtet . Die ideale Zustandsgleichung
lautet dann z.B. für N Teilchen :
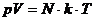 (y)
(y)
Die Konstante k ist die BOLTZMANNsche
Proportionalitätskonstante , deren Wert 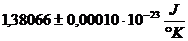 beträgt
beträgt . Bei
. Bei 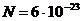 Teilchen , also gerade
einem mol Teilchen , ergibt sich für
Teilchen , also gerade
einem mol Teilchen , ergibt sich für  die Gaskonstante R
, womit die Gleichung wieder
die Gaskonstante R
, womit die Gleichung wieder 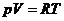 lautet . Ebenso läßt
sich auch die van-der-Waalssche Gleichung für N mol anwenden :
lautet . Ebenso läßt
sich auch die van-der-Waalssche Gleichung für N mol anwenden :
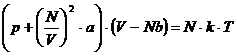 (z)
(z)
(siehe hierzu auch :
Greiner,Neise,Stöcker:Thermodyn. Und statist. Mechanik ,S.8,18,19)
Es gibt auch eine vereinfachte Form der van-der-Waals-Gleichung
, bei der nach Auflösen der Klammern das Glied 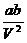 vernachlässigt wird ,
da es in vielen Fällen , wenn man für V=
vernachlässigt wird ,
da es in vielen Fällen , wenn man für V=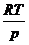 setzt , um den Wert 1 liegt , und bei
setzt , um den Wert 1 liegt , und bei 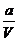 ebenfalls für V nach
der idealen Zustandsgleichung
ebenfalls für V nach
der idealen Zustandsgleichung 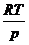 eingesetzt wird . Dann
erhält man :
eingesetzt wird . Dann
erhält man :
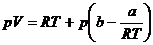 (A)
(A)
(siehe : BRDIČKA :
Grundlagen der physikal. Chemie , S. 247 )
Vergleicht man diese Gleichung mit der CLAUSIUSschen
Virialentwicklung , die beim linearen Term abgebrochen wurde , so sieht man ,
daß
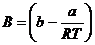 sein muß . Diese
Gleichung (A) zeigt auch , wie stark der Term
sein muß . Diese
Gleichung (A) zeigt auch , wie stark der Term 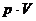 bei realen Gasen vom Wert RT bei idealen Gasen
abweicht . Bei niedrigen Temperaturen ist der Term
bei realen Gasen vom Wert RT bei idealen Gasen
abweicht . Bei niedrigen Temperaturen ist der Term 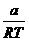 >b , so daß
>b , so daß 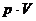 mit steigendem Druck
abnimmt , bei hohen Temperaturen ist b>
mit steigendem Druck
abnimmt , bei hohen Temperaturen ist b>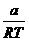 ,
, 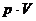 vergrößert sich also
mit steigendem Druck . Die Temperatur , bei der
vergrößert sich also
mit steigendem Druck . Die Temperatur , bei der 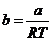 ist , ist die
kritische Temperatur , oder auch Boyle-Temperatur .
ist , ist die
kritische Temperatur , oder auch Boyle-Temperatur .
(vgl. hierzu : BRDIÇKA ,
Grundlagen der physikal. Chemie , S.247)
Abschließend hier noch einmal alle wichtigen Gleichungen und
Beziehungen :
Die ideale Zustandsgleichung für ein mol :
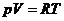
und für n mol :
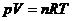
wobei 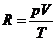 , je nach verwendeten
Einheiten , z.B.
, je nach verwendeten
Einheiten , z.B.
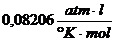 ist .
ist .
Die van-der-Waalssche Zustandsgleichung der realen Gase
lautet für ein mol :
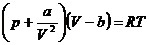
oder für N Teilchen :
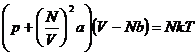
Die van-der-Waals-Gleichung nach p aufgelöst , ergibt die
Funktion
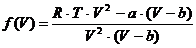 ,
,
deren Graphen das p-V-Diagramm der realen Gase zeigen .
Die Konstanten a , b und R stehen
folgendermaßen mit den kritischen Werten 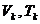 und
und 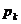 in Zusammenhang :
in Zusammenhang :
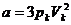 ;
; 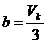 ;
; 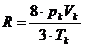
und
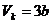 ;
; 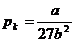 ;
; 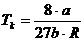
Die Clausiussche Virialgleichung lautet , wenn sie nach
Drücken entwickelt wird :
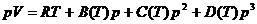 .
.
Sie wird der Einfachheit halber jedoch häufig beim linearen
Glied abgebrochen . Im Vergleich mit der vereinfachten van-der-Waalsschen
Gleichung 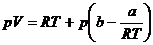 sieht man , daß der
Koeffizient B gleich
sieht man , daß der
Koeffizient B gleich
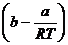 sein muß .
sein muß .
Literaturverzeichnis
BRDIČKA : Grundlagen der physikalischen Chemie
Berlin 1977
Greiner ,
Neise , Stöcker : Thermodynamik und
statistische Mechanik
Frankfurt a.M. 1987
Schülerduden : Die Chemie
Kurzverweise :
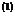 : BRDIČKA :
Grundlagen der physikalischen Chemie
: BRDIČKA :
Grundlagen der physikalischen Chemie
S. 246
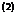 : BRDIČKA :
Grundlagen der physikalischen Chemie
: BRDIČKA :
Grundlagen der physikalischen Chemie
S. 250
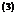 : BRDIČKA :
Grundlagen der physikalischen Chemie
: BRDIČKA :
Grundlagen der physikalischen Chemie
S. 253
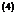 : Greiner , Neise ,
Stöcker : Thermodynamik und
: Greiner , Neise ,
Stöcker : Thermodynamik und
statistische Mechanik , S.9

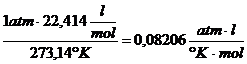
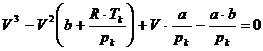 (k)
(k)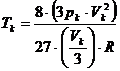 (v)
(v)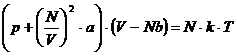 (z)
(z)