Halogenkohlenwasserstoffe
Halogenkohlenwasserstoffe sind
Derivate von Kohlenwasserstoffen. Allerdings sind bei den Halogenkohlenwasserstoffen ein oder mehrere Wasserstoffatome durch Halogenatome ersetzt.
Sie sind schwach polar, kaum wasserlöslich, aber unpolare Stoffe gut lösen (z. B. Fette). Daraus folgt, daß sie hydrophob und lipophil sind. Werden die Moleküle schwerer, so steigen auch die Schmelz- und Siedetemperatur an.
Wichtige Halogenkohlenwasserstoffe
Trichlormethan (Chloroform , CHCl
farblose Flüssigkeit, die sü lich riecht und nicht brennt. Die Dämpfe sind narkotisierend. Da Chloroform
giftig ist, dient es nicht mehr als Bet ubungsmittel.
Tertachlormethan Tetrachlorkohlenstoff, Tetra , CCl
flüßige, unbrennbare, cancerogene Substanz, Lösungsmittel für Fette und Harze
Dichloridfluormethan
(Frigen, Freon1 , CF Cl
unbrennbares,
ungiftiges,
geruchloses, sehr reaktionstr ges
Gas, unter Druck leicht verflüssigbar wie
andere FCKWs (Fluorchlorkohlenwasserstoffe).
Dient als Treibgas
und Kühlflüssigkeit in
Kühlschränken. Bromh ltige Substanzen als Feuerl schmittel in Gebrauch (Halon). In
vielen Staaten
verboten, da Schädigungen der Ozonschicht vermutet werden. In Österreich
d rfen nur mehr
teilhalogenierte Kohlenwasserstoffe
in Spraydosen erlaubt, da sie nicht so sch dlich f r die Ozonschicht sind wie die vollhalogenierten Fluorchlorkohlenwasserstoffe.
Chlorethan Ethylchlorid), C H Cl
Vereisungsmittel in der Medizin zur lokalen
Bet ubung (durch niedrige
Siedetemperatur
von 12 °C
sofortige Verdampfung T Unterkühlung der Haut T Schmerzunempfindlichkeit
Chlorethen Vinylchlorid , C H Cl
Grundstoff zur Herstellung von PVC
Trichlorehten(Trichlorethylen, Tri , C HCl und Tetrachlorethen (Perchlorethylen, Per), C Cl
Lösungsmittel in Putzereien (chemische Reinigung) und zum Entfetten von Eisenblech in der
Stahlindustrie
Halogenkohlenwasserstoffe kommen in der Natur nicht vor. Man muß extrem vorsichtig sein bei der Handhabung, da sie
zum
Teil hoch
giftig und
cancerogen
sind.
Halogenalkane
wird nur
sehr schwer
abgebaut, da sie chemisch sehr stabil sind. Sie werden leicht im Fettgewebe angereichert.
In Österreich
ist in einigen
Gebieten
das Grundwasser
schon verseucht, da halogenhaltige
L sungsmittel sehr sorglos verwendet wurden.
DDT Dichlordiphenyltrichlorethan) und HCH Hexachlorcyclohexan = Gammexan) finden als
Schädlingsbek mpfungsmittel Verwendung.
Chlorhaltiger
Kunststoffmüll
(PVC)
bildet
in
der
Müllverbrennung das hochgiftige Dioxin. Nun ist man bestrebt, die
Halogenkohlenwasserstoffe durch
harmlosere Substanzen zu ersetzen.
Reaktion und Herstellung
Charakteristisch für Halogenkohlenwasserstoffe sind Substitution und Elimination.
Substitution
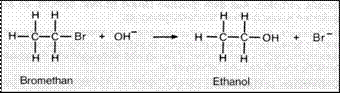
Bromethan hat eine polare C Br Bindung.
Das Br Atom
zieht die
Bildungselektronen zu sich, das C Atom hat daher eine negative
Partialladung. Die OH -Ionen streben
zur
positiven
Ladung (nucleophil) und
verdrängen das Halogenatom.
Das OH Ion
n hert sich dem Bromethan von der dem Brom gegenüberliegenden Seite. Im labilen Übergangszustand
liegen die H Atome in einer Ebene. Senkrecht
dazu befinden sich die ein- und austretenden
Gruppen in
ungef hr gleichem Abstand.
Die eintretende Gruppe
bindet sich schließlich an den Kohlenstoff, die H- Atome klappen wieder in Tetraederanordnung, aber in die andere Richtung (Umklappen wie
ein Regenschirm) und Br wird abgegeben.
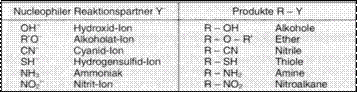
Nucleophile Substitutionsreaktionen
von Halogenalkanen
sind von großer synthetischer Bedeutung , da die
verschiedensten
funktionellen Gruppen in das C Gerüst eingebaut werden können. Fluoralkane sind extrem
reaktionstr ge, Iodalkane reagieren
am
leichtesten. Das
hat
mit der
Größe
der
Elektronenh lle.
Dadurch wird ihre
Abspaltung als Anion erleichtert.
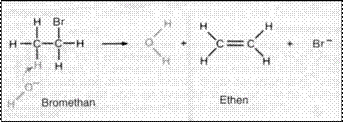
Elimination
Ethen
entsteht, wenn
Bromethan mit konzentrierter Natronlauge reagiert. Jedes
Nucleophil hat auch
basische Eigenschaften, d h. es kann auf Grund seines Elektronenüberschusses ein H -Ion binden.
Eine Doppelbindung wird ausgebildet und vom
benachbarten C Atom wird ein Bromidion abgegeben, weil das OH Ion
dem Halogenalkan ein Proton entzieht.
Eliminierungen sind
immer
Konkurrenzreaktionen zur
nukleophilen Substitution
Eliminierungsreaktionen f hren zur Bildung unges ttigter Verbindungen. Halogenalkane entstehen aus:
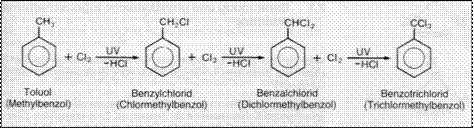
Alkanen durch radikalische Substitution
Alkenen und Alkinen durch Addition von Halogenen oder Halogenwasserstoffen
Alkoholen durch Substitution der OH Gruppe durch ein Halogenidion
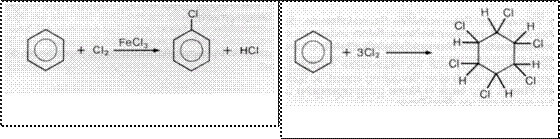
Bei Halogenderivaten aromatischer Kohlenwasserstoffe treten Additionen oder Substitutionsreaktionen auf.
Eine elektrophile Substitution findet statt, wenn Benzol in Dunkelheit unter Anwesenheit eines Katalysators AlCl FeCl mit Chlor reagiert.