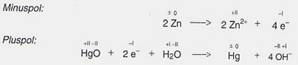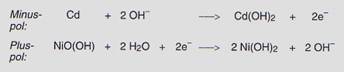ELEKTROLYSE
UND GALVANISCHE ELEMENTE
1 Redox-Reaktionen nutzbar gemacht - galvanische
Zellen
Naturwissenschaftler bemühen sich,
Zusammenhänge und Gesetzmäßigkeiten in Naturerscheinungen zu entdecken und zu
beschreiben. Auf ihren Ergebnissen aufbauend können dann Techniker Verfahren
entwickeln und Geräte bauen, in denen die wissenschaftlichen Erkenntnisse
praktische Anwendung finden.
Interessante Beispiele für diese
Zusammenarbeit zwischen Wissenschaft und Technik findet man in der Entwicklung
moderner Batterien und anderer Stromversorgungsgeräte. Hier haben
Wissenschaftler gezeigt, auf welche Weise es grundsätzlich möglich ist,
elektrische Energie aus chemischen Vorgängen zu gewinnen.
1.1 Galvanische Zellen
Taucht man ein Zinkblech in eine wässrige
Lösung von Kupfersulfat, so gehen Elektronen von der Oberfläche des Zinkblechs auf die Kupfer-Ionen über. Zink
wird oxidiert, Kupfer-Ionen werden reduziert. Lasst man beide Teilreaktionen
räumlich getrennt ablaufen, so lässt sich der Elektronenfluss technisch nutzen.
Dies geschieht in einer galvanischen Zelle.
Um eine solche Zelle aufzubauen, stellt man
ein Zinkblech in eine Zinksalz-Lösung und ein Kupferblech in eine Kupfersulfat-Lösung. Beide Halbzellen sind
durch eine poröse Wand, das Diaphragma, getrennt. Zwischen dem Zinkblech und
dem Kupferblech besteht eine Potentialdifferenz (Spannung).
Verbindet man die beiden
Metalle durch einen Draht miteinander, so fließt ein Strom, mit dem ein kleiner
Motor betrieben werden kann. Das Zink bildet bei dieser Anordnung den Minuspol.
Elektronen fließen vom Zink zum Kupferblech, dem Pluspol. An der
Metalloberfläche werden die Kupfer-Ionen der Salzlösung zu metallischem Kupfer reduziert.
In der Zink-Halbzelle gehen Zink-Ionen in Lösung. Es laufen also folgende
Halbzellen-Reaktionen ab.
Minuspol Zn Zn2+ 2 e-
Pluspol:
Cu2+ + 2e- → Cu
Eine
galvanische Zelle besteht aus zwei verschiedenen Halbzellen, die
elektrisch leitend miteinander verbunden sind.
Mit dem Standard- Elektrodenpotential wird das
Redoxverhalten eines Redoxpaares Men+/Me quantitativ erfasst. Man
hat sich darauf geeinigt, zur Bestimmung von Standard- Elektrodenpotentialen
die Wasserstoffhalbzelle als Bezugshalbzelle zu verwenden. In einer
Galvanischen Zelle wird die Wasserstoffhalbzelle mit einer Halbzelle
kombiniert. Das gemessene Potential nennt man Standard-Elektrodenpotential. Je
kleiner das Redoxpotential ist, desto größer ist die Reduktionswirkung des
Metalls und desto schwächer, die Oxidationswirkung des Metall-Ions.
Unedle Metalle sind daher durch ein negatives, edle durch ein positives
Standard- Elektrodenpotential gekennzeichnet.
Ahnlich wie bei der
Wasserstoffhalbzelle lassen sich Halbzellen mit nichtmetallischen Redoxpaaren
aufbauen und so auch deren Standard-Elektrodenpotentiale bestimmen.
Ordnet man alle
Redoxpaare nach ihren Standard- Elektrodenpotentialen, erhält man die so
genannte Spannungsreihe.
Die Spannungsreihe
liefert wichtige Informationen über den Verlauf von Redoxreaktionen in
wässriger Lösung, da hier die Reduktions- bzw. die Oxidationswirkung der
Redoxpaare erfasst wird. Je kleiner das Standard- Elektrodenpotential ist,
desto stärker reduzierend wirkt das Redoxsystem.
Auch
die Elektroden können als Oxidations- bzw. Reduktionsmittel angesehen werden,
da sie Elektronen abgeben bzw. aufnehmen.
Die
Anode ist so das stärkste Oxidationsmittel, die Katode das stärkste
Reduktionsmittel.
|
oxidierte
Form
|
reduzierte
Form
|
U/V
|
|
Li+(aq)
+ e-
|
Li(s)
|
|
|
Na+(aq)
+ e-
|
Na(s)
|
|
|
Al3+(aq)
+ 3e-
|
Al(s)
|
|
|
Zn2+(aq)
+ 2e-
|
Zn(s)
|
|
|
222222222Sn2+(aq)
+ 2e-
|
Sn(s)
|
|
|
Pb2+(aq)
+ 2e-
|
Pb(s)
|
|
|
Cu2+
+ e-
|
Cu+(s)
|
|
|
Ag+(aq)
+ e-
|
Ag(s)
|
|
Spannungsreihe.
Standard- Elektrodenpotentiale U einiger Redoxpaare
1.2
Elektrodenpotentiale und Reaktionsverhalten
Verhalten von Metallen gegenüber sauren
Lösungen
Unedle Metalle haben ein negatives Standard-
Elektrodenpotential. Sie lösen sich in saurer Lösung unter
Wasserstoffentwicklung:
2 Me(s) + 2 n H+(aq) ---> 2 Men+ + (aq) + n H2(g)
Edelmetalle haben ein positives Redoxpotential. Sie lassen sich nicht von
Hydronium-Ionen oxidieren. So reagiert Kupfer nicht mit verdünnter Salpetersäure.
Königswasser
Wegen ihres höheren Redoxpotentials werden
Gold und Platin von Salpetersäure nicht angegriffen. Diese Metalle lösen sich
aber in Königswasser, einem Gemisch aus einem Teil konzentrierter Salpetersäure
und drei Teilen konzentrierter Salzsäure. Es läuft folgende Redoxreaktion ab:
HNO3(aq)
+ 3 HCl(aq) --> NOCI(aq)
+ Cl2(g) + 2 H2O(l)
Neben Nitrosylchlorid liegt freies Chlor vor,
dass die Metalle unter Bildung von Chloro-Komplexen ([AuCl4]-,
[PtCl6]2- ) oxidiert:
Au(s) + 4 CI-(aq) --> [AuC14]
(aq) + 3e- U= 1,00 V
aq . . . in Wasser gelöst (aquatisiert) g . . . gasförmig (gas) l . . . flüssig (liquid) s . . . fest (solid)
Atzen von Platinen, Reinigung von Silber
In der Elektrotechnik wird bei der Herstellung
von Platinen Kupfer von einer Trägerplatte an den Stellen abgelöst, an denen
keine Leiterbahnen benötigt werden. Dazu taucht man die Platten in eine
Eisen(III)-chlorid-Lösung. Aufgrund des höheren Redoxpotentials von U(Fe3+/Fe2+)
= 0,77 V sind die Eisen(III)-Ionen in der Lage, Kupfer zu Kupfer(II)-Ionen zu
oxidieren.
Silberne Gebrauchsgegenstände laufen an, da
Silber mit Schwefelwasserstoff reagiert. Zur Reinigung des angelaufenen Silbers
werden Putzmittel angeboten. Beim Putzen wird eine dünne Silberschicht
abgerieben. Es geht also immer ein wenig Silber verloren.
Angelaufene Silbergegenstände kann man ohne
Silberverlust reinigen, indem man das Silber in einer Natriumchlorid-Lösung auf
Aluminiumfolie legt. Dabei reduziert Aluminium die Silber-Ionen aus der
Anlaufschicht wieder zu Silber und Aluminium-Ionen gehen in Lösung.
1.3 Batterien
Batterien sind
ortsunabhängige Spannungsquellen, bei denen die zum Betrieb von Geräten
benötigte elektrische Energie elektrochemisch erzeugt wird. Batterien sind somit
spezielle galvanische Zellen. Die verschiedenen Batterietypen unterscheiden
sich durch die in ihnen ablaufenden Redoxreaktionen und durch ihren Bau.
Die
an den Elektroden ablaufenden Reaktionen entscheiden über die Spannung der
Batterie. Um hohe Spannungen zu erreichen, muss man ein unedles Metall am
Minuspol mit einem starken Oxidationsmittel am Pluspol kombinieren.
Aus praktischen und ökonomischen Gründen ist die
Auswahl sehr beschränkt. So eignet sich als negative Elektrode besonders gut
das Metall Zink. Auch Lithium und Natrium werden verwendet. Neben der Spannung
sind auch die erreichbare Stromstärke und die Kapazität einer Batterie von
Bedeutung. Sie werden durch die Größe der Elektroden und die Art der
Elektrolytlösung beeinflusst.
Die LECLANCHE-Batterie
Die
am häufigsten verwendete Batterie ist die so genannte Taschenlampenbatterie.
Sie geht auf eine Entwicklung des französischen Ingenieurs Georges LECLANCHE
zurück, der seine Erfindung 1867 auf der Weltausstellung in Paris vorstellte.
Bei
der heutigen Ausführung der LECLANCHE-Batterie ist der Batteriebehälter aus
Zink gleichzeitig der Minuspol. Den Pluspol bildet ein Graphitstab, der von
einem Gemisch aus Graphit und Braunstein umgeben ist.
Als Elektrolyt dient
eine 20%ige Ammoniumchlorid-Lösung, die mit Quellmitteln wie Stärke oder
Sägemehl eingedickt ist.
Beim
Betrieb der LECLANCHE-Batterie wird am Minuspol das Zink oxidiert, Zink-Ionen
gehen in den Elektrolyten über:
Zn →
Zn2+ + 2e-
Die Reaktionen am Pluspol sind kompliziert.
Letztlich wird Braunstein reduziert. Dabei werden Hydronium-Ionen aus der
schwach sauren Ammoniumchlorid-Lösung verbraucht:
Die Arbeitsspannung sinkt bei fallender
Temperatur stark ab, da die Beweglichkeit d. Ionen u. die Löslichkeit im
Elektrolyten abnehmen. Unterhalb von - 20 °C gefriert der Elektrolyt;
Ionenwanderung ist dann kaum möglich.
LECLANCHE-Batterien lassen sich nicht
beliebig lange ohne Qualitätsminderung lagern. Schon durch geringen Wasserverlust
wird die Elektrolytpaste zäh, und Salze kristallisieren aus. Verunreinigungen
des Zinks durch Spuren von Eisen und Kupfer führen zur Ausbildung von
Lokalelementen und wirken korrodierend, sodass schon während der Lagerung
Zink-Ionen in Lösung gehen.
Die Alkali-Mangan-Batterie
Eine
Weiterentwicklung der LECLANCHE-Batterie ist die Alkali-Mangan-Batterie. Der
Batteriebecher besteht aus Stahl, der an den elektrochemischen Reaktionen nicht
teilnimmt. Somit ist die Batterie nahezu auslaufsicher. Am Minuspol liegt eine
Paste aus amalgiertem Zinkpulver vor. Durch die größere Zinkoberfläche kann pro
Zeiteinheit mehr Zink oxidiert werden und durch das freigesetzte Quecksilber
wird der Innenwiderstand der Batterie verringert.
So können über
längere Zeit höhere Entladeströme fließen, ohne dass die Spannung zu weit
absinkt. Als Elektrolyt wird Kaliumhydroxid-Lösung verwendet. Da die
Kaliumhydroxid-Lösung erst bei - 60 °C vollständig erstarrt ist die
Alkali-Mangan-Batterie auch bei tiefen Temperaturen einsetzbar.
Die Zink-Luft-Batterie
Anstelle Braunsteins lässt sich auch der Luftsauerstoff als
Oxidationsmittel nutzen. In der Zink-Luft-Batterie bildet Zink den Minuspol und
ein Graphitstab den Pluspol. Die Graphit-Elektrode taucht nur teilweise in die
als Elektrolyt verwendete Kaliumhydroxid-Lösung. Der andere Teil steht mit
Luftsauerstoff in Verbindung, der von der Elektrode absorbiert wird.
Unter der katalytischen Wirkung des Elektrodenmaterials wird der
Sauerstoff zu Hydroxid-Ionen reduziert, gleichzeitig wird das Zink oxidiert.
Die Zink-Ionen reagieren mit den Hydroxid-Ionen weiter zu Hydroxozinkat-Ionen
([Zn(OH)4]2-).
Die Zink-Luft-Batterie wird als Großbatterie
für Langzeitanwendungen eingesetzt, so für Weidezaungeräte und
Baustellenbeleuchtungen. Als Knopfzelle findet sie in Hörgeräten Verwendung.
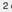
Die Quecksilberoxid-Batterie und die Silberoxid-Batterie
Vorteilhaft für die elektrischen
Eigenschaften ist die Verwendung von Quecksilberoxid oder Silberoxid als
Oxidationsmittel am Pluspol. Als Reduktionsmittel verwendet man in
Quecksilberoxid- und Silberoxid-Batterien ebenfalls Zink. Als Elektrolyt dient
Kaliumhydroxid-Lösung. In der Quecksilberoxid-Batterie laufen folgende
Reaktionen ab:
Quecksilberoxid- und Silberoxid-Batterien
haben einen großen Vorteil: die Spannung von 1,3 V bzw. 1,5 V bleibt während
ihrer gesamten Betriebszeit konstant. Sie werden meist als Knopfzellen
gefertigt. Verwendung: Fotoapparate, Armbanduhren und Messgeräte.
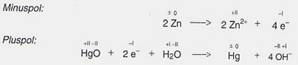
Die Lithium-Batterie
Aufgrund seiner Stellung in der
Spannungsreihe und seiner geringen Dichte ist Lithium bestens als Elektrodenmaterial
für den Minuspol in Batterien geeignet. Lithium reagiert aber lebhaft mit
Wasser, sodass man in der Batterie nur nichtwässrige Elektrolyte einsetzen
kann. Für den Pluspol werden unterschiedliche Oxidationsmittel verwendet. Eine
Elektrode aus Edelstahl steht in Kontakt mit Chromoxid (CrOx),
Braunstein, Thionylchlorid (SOCl2) oder Bismutoxid (Bi2O3).
Dabei ergeben sich je nach Oxidationsmittel unterschiedliche
Batteriespannungen.
Als
Beispiel soll das System Li/CrOx dargestellt werden. Man verwendet
ein Gemisch von Chromoxiden, deren Gesamtzusammensetzung etwa der Formel Cr3O8
entspricht. Bei der Zellreaktion wird Lithium zu Lithium-Ionen oxidiert, und
Chromoxide werden reduziert. Im rechnerischen Durchschnitt nimmt ein Chrom-Ion
dabei 1,4 Elektronen auf.
Als
Elektrolyt wird in dieser Lithium-Batterie eine Lösung von Lithium-perchlorat
(LiClO4) in einem polaren organischen Lösungsmittel eingesetzt.
Lithium-Batterien
zeichnen sich durch sehr geringe Selbstentladung und somit hohe Lagerfähigkeit
aus. Bei geringen Entladeströmen eignen sie sich für Langzeitanwendungen von
bis zu 10 Jahren. So werden sie in EDV-Anlagen in die Platinen von
Datenspeichern eingelötet. Lithium-Batterien sind bei Temperaturen bis zu - 40
°C einsetzbar.
Batterien
im Müll - ein Umweltproblem?
In Österreich werden pro Jahr etwa 50 Millionen Batterien
verkauft. Nach ihrem Gebrauch fällt damit insgesamt eine Menge von rund 2000
Tonnen Altbatterien an. Die Entsorgung über den Hausmüll ist sehr
problematisch, da in diesen Batterien mehr als 7 Tonnen giftiges Quecksilber
enthalten sind.
Der größte Teil davon
entfällt auf die Alkali-Mangan-Batterien. Sie enthalten zwar nur etwa 1 %
Quecksilber, haben aber an der Gesamtmasse einen viel größeren Anteil als die
Quecksilberoxid-Batterien.
Der Anteil des Quecksilbers im Hausmüll beträgt etwa 3
ppm (parts per million). Die Hälfte davon ist auf Batterien zurückzuführen. In
der Hausmülldeponie korrodieren die Batterien nach einiger Zeit. Das
freigesetzte Quecksilber verdampft teilweise in die Atomsphäre, zum anderen
Teil wird es in der Deponie gebunden. In Müllverbrennungsanlagen verdampft das
Quecksilber vollständig. Die Hälfte der Emissionen an Quecksilber aus
Müllverbrennungsanlagen stammt aus Batterien. So gelangt jährlich eine knappe
Tonne in die Atmosphäre.
Aus der Luft gelangt schließlich immer mehr Quecksilber
in den Boden und in das Wasser. Eine akute Gefährdung durch das Quecksilber
besteht zwar nicht, aber ökologische Schäden sind langfristig zu befürchten, da
Organismen im Boden und im Wasser giftige organische Quecksilberverbindungen
aufbauen, die sich in der Umwelt und vor allem in der Nahrungskette anreichern
können.
Neben Quecksilber enthalten Batterieabfälle auch das
giftige Cadmium. Es stammt hauptsächlich aus den immer beliebter werdenden,
wiederaufladbaren Nickel-Cadmium-Batterien. Ein Viertel der Cadmiumbelastung im
Müll ist auf diese Batterien zurückzuführen.
Quecksilberhältige Batterien und cadmiumhältige Batterien
gehören also nicht in den Hausmüll, sondern sollten gesondert gesammelt werden.
Nur so können sie in einer Sondermülldeponie eingelagert oder einem Recycling
zugeführt werden.
Recycling
Knopfzellen werden vom Handel zurückgenommen. Wegen ihrer
Form lassen sie sich auch leicht aus dem Batteriemüll aussortieren. Aufgrund
des hohen Gehalts an Quecksilber und wertvollem Silber werden
Recycling-Verfahren seit Jahren wirtschaftlich lohnend durchgeführt. Die
Stahlmantel werden zerschlagen, und zunächst wird das Quecksilber
abdestilliert. Danach wird das fein verteilte Silber zusammengeschmolzen.
Die quecksilberhältigen Alkali-Mangan-Batterien lassen
sich nur schwer aus den gesammelten Batterien abtrennen, da sie die gleiche
Form aufweisen wie die LECLANCHE-Batterien. Unsortiert ist aber die Entsorgung
problematisch. Bei der Lagerung auf einer Sondermülldeponie werden 65 % der
Altbatterien praktisch unnötigerweise gelagert, da die LECLANCHE-Batterien kein
Quecksilber enthalten. Recycling ist aber wegen des geringen Quecksilbergehalts
an der Gesamtmasse unwirtschaftlich. Einen Fortschritt könnte hier ein
Recycling-Verfahren bringen, bei dem auch Zink und Braunstein zurückgewonnen
werden.
Beim umweltbewussten Einsatz von Batterien muss man also
überlegen, ob man statt Alkali-Mangan-Batterien LECLANCHE-Batterien und statt
Quecksilberoxid-Knopfzellen Zink-Luft-Knopfzellen oder Lithium-Knopfzellen
verwendet. Darüber hinaus ist vorgesehen, den Quecksilbergehalt der
Alkali-Mangan-Batterien von 1 % auf 0,15 % herabzusetzen.
1.4 Akkumulatoren
Die
bisher vorgestellten Batterien haben den Nachteil, dass sie nach Gebrauch nicht
wieder regeneriert werden können. Große praktische Bedeutung kommt daher den
Akkumulatoren zu. Bei diesen Batterien lassen sich die bei der Stromerzeugung
ablaufenden Reaktionen wieder rückgängig machen.
Der Bleiakkumulator
In
geladenem Zustand besteht jede Zelle des Bleiakkumulators aus einer
Blei-Elektrode und einer Bleidioxid-Elektrode, die in Schwefelsäure (20 %) als
Elektrolyt eintauchen. Jede einzelne Zelle besitzt eine Spannung von etwa 2 V.
Bei Stromentnahme laufen an den Elektroden folgende Reaktionen ab:
Minuspol: Pb --> Pb 2+ + 2 e-
Pluspol: PbO2 + 4 H+ + 2
e - --> Pb 2+ + 2 H2O
Die an beiden Polen entstehenden
Blei(Il)-Ionen bilden mit den Sulfat-Ionen des Elektrolyten einen
schwerlöslichen Niederschlag von Bleisulfat, der sich auf den Elektroden
absetzt. Außerdem entsteht bei der Stromerzeugung Wasser. Die Reaktion lässt
sich umkehren, der entladene Bleiakku kann also wieder aufgeladen werden.
Pb + PbO2 + 2 H2SO4  2 PbSO4 + 2 H2O
2 PbSO4 + 2 H2O
Die
Umkehrreaktion wird erzwungen, indem man durch Anlegen einer Spannung an die
Elektroden die Stromrichtung umkehrt. Dabei werden am Minuspol Blei(Il)-Ionen
wieder zu Blei reduziert und am Pluspol Blei(Il)-Ionen wieder zu Blei(IV)-oxid
oxidiert.
Beim Ladevorgang könnte man erwarten, dass
der Bleiakku als Elektrolytzelle arbeitet und die schwefelsaure Lösung unter
Bildung von Wasserstoff und Sauerstoff elektrolysiert wird. Die Entwicklung von
Wasserstoff an einer Bleielektrode und die Abscheidung von Sauerstoff einer
Bleidioxid-Elektrode sind jedoch stark behindert, sodass bevorzugt die
Blei(Il)-Ionen an den Elektroden reagieren. So wird das Laden des
Bleiakkumulators überhaupt erst möglich.
Solange noch festes
Bleisulfat vorhanden ist, bleibt während des Ladevorgangs die Konzentration an
Blei(Il)-Ionen im Elektrolyten auf Grund des Löslichkeitsgleichgewichts nahezu
konstant. Gegen Ende der Aufladung aber nimmt dann die Konzentration an
Blei(Il)-Ionen schlagartig ab, und es kommt schließlich zur Entwicklung von
Wasserstoff und Sauerstoff. Dann läuft die Elektrolyse des Wassers ab, der Akku
gast.
Der Nickel-Cadmium-Akkumulator
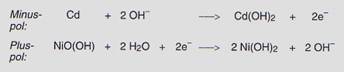 Im geladenen Zustand
bestehen die Elektroden dieses Akkumulators aus Platten, die am Minuspol mit
fein verteiltem Cadmium und am Pluspol mit Nickel(III)-oxidhydroxid beladen
sind. Als Elektrolyt wird Kaliumhydroxid-Lösung (20 %) verwendet. Der
Nickel-Cadmium-Akkumulator liefert eine Spannung v. 1,3 V. Beim Entladen laufen
folgende Reaktionen ab:
Im geladenen Zustand
bestehen die Elektroden dieses Akkumulators aus Platten, die am Minuspol mit
fein verteiltem Cadmium und am Pluspol mit Nickel(III)-oxidhydroxid beladen
sind. Als Elektrolyt wird Kaliumhydroxid-Lösung (20 %) verwendet. Der
Nickel-Cadmium-Akkumulator liefert eine Spannung v. 1,3 V. Beim Entladen laufen
folgende Reaktionen ab:
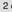
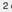
Durch Anlegen einer
genügend großen Spannung lassen sich die Elektrodenreaktionen umkehren.
Entladen
Cd + 2 NiO(OH) + 2 H2O
 Cd(OH)2 + 2 Ni(OH)2
Cd(OH)2 + 2 Ni(OH)2
Laden
Der Nickel-Metallhybridakku
Vorteile des NiMH-Akkus:
Cadmiumfrei (umweltschonend!)
Höhere Energie von 50-70 Wh/Kg
Weist ähnliche Spannung wie NC-Zellen auf
Hohe Lebensdauer (bis 2000 Zyklen)
Ladewirkungsgrad bis zu 92%, dazu noch eine rel. kurze Ladezeit
Geringe Wartung benötigt
Nachteile des Ni/MH-Akkus:
Hoher Preis
Hochstromentladung max. 3C
Schnelle Selbstentladung
Starke Ausdehnung der Kristallgitter beim Ladevorgang daraus folgt eine
Verringerung der Lebensdauer
Irreversible Oxidation der H2-Speicherlegierungen à Memory Effekt
Die Nickel-Metallhydrid-Batterie entstand bei der Suche nach einer
Zelle mit vergrößerter Kapazität und verbesserter Umweltverträglichkeit. Die
Negative, strukturell recht einfache Cadmium-Elektrode wurde hier durch eine
Metalllegierung mit komplexer Struktur ersetzt, die fähig ist, Wasserstoff zu
absorbieren.
Das Legierung-Wasserstoff-System weist eine hohe Energiedichte auf, was
erlaubt, die Masse der negativen Elektrode zu verringern und das gewonnene
Volumen mit positiver Masse aufzufüllen.
Dadurch erhöht sich die Energiedichte im Vergleich zu NiCd-Zelle.
Aufbau und Funktionsweise einer Ni-MH Zelle
Die Anode (-) besteht hier nicht aus Cadmium, sondern aus einer
wasserstoffspeichernden Nickellegierung. Die Kathode besteht wie schon beim
Ni/Cd-Akku aus Nickel.
Auch das Elektrolyt ist dasselbe, und zwar Kaliumhydroxid-lösung.
Beim Entladen laufen allgemein folgende Reaktionen ab:
MH + NiOOH -> M + Ni(OH)2
Es entsteht eine Leerlaufspannung von 1,25 bis 1,35 V. Sie ist vom
Ladezustand, der Lagerungszeit und der Temperatur abhängig. Unmittelbar nach
der Ladung kann auch mal 1,45V gemessen werden.
Die Nennspannung beträgt dennoch 1,2 V (ein Mittelwert der Spannungen im
Arbeitszyklus).
Die Entladeschlussspannung beträgt 1V, bei höheren Entladeströmen kann sie auch
auf 0,9V fallen.
Der Maximale Entladestrom beträgt nur 3C.
Die NiMH-Zellen sind nur eingeschränkt für unsere Zwecke brauchbar, da
der maximale Entladestrom mit 3C vergleichsweise gering ist.
Brauchbar sind die Zellen jedoch für den "Next Generation", der im Schwebeflug
weit weniger als 1A verbraucht. Bei den Indoor- und Parkflyeren wird der
Spitzenstrom zu hoch sein und die Zellen beschädigen.
Lithium-Ionen-Zellen:
beide Elektroden aus Einlagerungsverbindungen und flüssigem oder festem
Polymer-Elektrolyten.
Merkmale:
Sicherer Aufbau
Hohe Lebensdauer
Relativ große Selbstentladung
Mittlere Entladungsströme
Beispiele: LixC/LiCOO2, LixC/LiNiO2,
LixC/LiMnO4
Zellen mit anorganischem Elektrolyten:
flüssige
Kathode, die gleichzeitig als Lösungsmittel des Elektrolyten dient.
Merkmale:
Hohe spezifische Energiedichte
Hohe Entladungsströme
Sehr gute Lagerungsfähigkeit
Widerstandsfähigkeit gegen Überladung
Sicherheitsprobleme (sehr giftig)
Kapazitätsverlust im Laufe des Lebens
Beispiele: Li/SO2, Li/CuCl2
Lithium-Legierungs-Zellen:
Anode aus Lithium-Legierung, flüssiger organischer Elektrolyt,
verschiedene Kathoden.
Merkmale
Knopfzellenkonstruktion
Mehr Sicherheit durch Lithium-Legierung
Niedrige Energiedichte
Kurze Lebensdauer (außer für geringere Entladungstiefe)
Beispiele: LiAl/MnO2, LiAl/V2O5, LiAl/C, LiC/V2O5,
LiAl/Polymer
Die einzige Zelle aus der Lithium-Familie die für uns in Frage kommen
könnte, ist die Lithium-Ionen Zelle.
Sie besitzt eine extrem hohe Kapazität und eine hohe Zellspannung von 3,7V.
Widrigerweise beträgt die maximale Belastbarkeit nur 2C. Da die Kapazität der
Zellen entsprechender Größe jedoch über 1000mAh beträgt, reichen hier 2C für
den "Next Generation" aus.
Leider ist der Anschaffungspreis hoch.
Die Autobatterie
Der
größte Teil der knapp 1 Million in Österreich jährlich verkauften Bleiakkumulatoren
findet als Starterbatterie in Kraftfahrzeugen Verwendung.
Aufbau und Herstellung. Damit die Batterie beim Startvorgang kurzzeitig
einen sehr hohen Strom liefern kann, müssen die Elektrodenflächen möglichst
groß sein. Daher baut man in die Batterie viele dünne Elektrodenplatten ein.
Die Platten bestehen aus einem Trägergitter und dem elektrochemisch aktiven
Material. Da reines Blei weich und leicht verformbar ist, verwendete man für
die Gitter lange Zeit Hartblei, eine Legierung aus
Blei und 4% bis 10% Antimon. Der Antimonzusatz verbessert zwar die Festigkeit
der Gitter und die Eigenschaften der Schmelze beim Gießen, er bringt aber
Nachteile für das elektrochemische Verhalten des Akkus beim Betrieb. Man
verwendet daher heute für die Gitter antimonarme Bleilegierungen (bis 1,7%
Antimon) mit Zusätzen von Arsen (0,1 %), Kupfer (0,03 %), Zinn (0,01 %) und
Selen (0,02 %).
Zur
Herstellung des aktiven Materials geht man ausschließlich von reinem Blei (Weichblei)
aus.
Geschmolzenes Blei wird in feinen Tröpfchen an der Luft so weit oxidiert, bis
ein Gemisch von etwa gleichen Anteilen Blei und Bleioxid entstanden ist. Dann
wird das Material zu Pasten angerührt. Um an den negativen Platten eine feinste
Verteilung des Bleis mit einer großen Oberfläche zu erhalten, werden der Paste
Bariumsulfat, Ruß und Lignin als Spreizmittel zugesetzt. Die Paste für die
positiven Platten erhält normalerweise keine Zusätze. Die Pasten werden in die
Gitter gestrichen und anschließend getrocknet. Dann werden die Platten für den
Minuspol und den Pluspol elektrochemisch hergestellt: Bleioxid wird zu Blei
reduziert bzw. Bleioxid und Blei werden zu Bleidioxid oxidiert.
Die Platten einer
Akkuzelle werden zu negativen und positiven Plattensätzen verschweißt. Für die
Strom führenden Teile und die Pole verwendet man sogenanntes Schweißblei,
das
ist Hartblei mit 3% bis 6% Antimon. Um 12 V Spannung zu erreichen, schaltet man
sechs Akkuzellen hintereinander. Die Schwefelsäure wird erst kurz vor Gebrauch
eingefüllt, denn mit diesem Zeitpunkt setzt auch die Alterung der Batterie ein.
Alterung. Obwohl der Bleiakkumulator nach dem Start von der Lichtmaschine wieder
geladen wird, besitzt er nur eine begrenzte Lebensdauer. Dafür sind
Veränderungen an den Platten verantwortlich.
An den negativen Platten kann das feinkörnige Blei (Schwammblei)
rekristallisieren,
es wird kompakter und verliert seine große aktive Oberfläche. Mit der Zeit kann
auch das beim Entladen entstandene Bleisulfat auf den Platten größere Kristalle
bilden, die beim Laden nicht mehr vollständig gelöst werden.
An
den positiven Platten kann beim Laden und Entladen ein Teil des porös
aufgetragenen Bleidioxids die Haftung ans Gitter verlieren und abschlammen.
Wird der Akku längere Zeit nicht voll geladen oder wird er tiefentladen, kommt
es zu Korrosionsvorgängen an den Gittern der positiven Platten. Teile des
Gitters, und damit auch Bleidioxid platzen ab. All diese Vorgänge führen dazu,
dass die Leistung und die Kapazität des Bleiakkumulators während des Betriebs
zunehmend geringer werden.
Moderne
Batterien sind wartungsfrei. Durch die Verwendung antimonarmer Bleilegierungen
für die Gitter wird das Gasen beim Laden verhindert. Somit braucht kein
elektrolytisch zersetztes Wasser mehr nachgefüllt zu werden.
Soll ein Motor bei tiefen
Temperaturen gestartet werden, kann es vorkommen, dass die Leistung der
Batterie nicht mehr ausreicht. Der Motor benötigt hauptsächlich wegen des bei
tiefen Temperaturen zähflüssigen Motoröls eine höhere Startleistung. Aber durch
die geringere Ionenbeweglichkeit und die Verlangsamung der Reaktionen nimmt der
Innenwiderstand der Batterie zu. So sinkt bei fallenden Temperaturen die
Arbeitsspannung der Batterie und die entnehmbare Strommenge. Eine Faustregel
besagt, dass man ausgehend von 27 °C pro Grad Temperaturerniedrigung mit einer
Kapazitätsminderung von etwa 1,3% rechnen muss.
Über 90% der ausgedienten
Bleiakkus werden wiederaufgearbeitet. Aus den Platten gewinnt man Hartblei
zurück. Die Kunststoffbehälter verarbeitet man zu Granulat, aus dem sich neue
Gegenstände fertigen lassen.
1.5
Brennstoffzellen
In
galvanischen Zellen wird die bei einer Redoxreaktion freiwerdende Energie
direkt in elektrische Energie umgewandelt. Auch Verbrennungsreaktionen sind
Redoxreaktionen. Sie lassen sich daher in galvanischen Zellen zur
Stromerzeugung einsetzen. Man muss nur dafür sorgen, dass die Brennstoffe
kontinuierlich nachgeführt werden, sodass über längere Zeit Energie
bereitgestellt wird. Solche Zellen heißen Brennstoffzellen.
Knallgaszellen
In einer Wasserstoff-Sauerstoff-Brennstoffzelle
wird die stark exotherm verlaufende Oxidation von Wasserstoff zur
Stromerzeugung genutzt. Allerdings reagieren Wasserstoff und Sauerstoff nicht
direkt miteinander. Durch die räumliche Trennung der beiden Reaktionspartner
wird der größte Teil der chemischen Energie in elektrische Energie umgewandelt.
In einer Zelle mit Kalilauge als Elektrolyten laufen an den Elektroden die
folgenden Reaktionen ab:
Minuspol: 2 H2 + 4 OH-
→ 4 H2O + 4e- U= - 0,87 V
Pluspol: O2 + 2 H2O
+ 4e- → 4 OH- U= 0,36 V
Gesamtreaktion: 2 H2 + O2 → 2 H2O U= 1,23 V
Möglichkeiten und Probleme
Brennstoffzellen sind in den letzten Jahren
viel in der Raumfahrt eingesetzt worden. Die Apollo- Raumfahrzeuge wurden mit Strom
aus Wasserstoff-Sauerstoff-Brennstoffzellen versorgt. Die beiden Gase wurden in
flüssiger Form in Tanks mitgeführt. Das Endprodukt der Reaktion diente als
Trinkwasser. Das Gesamtgewicht des Stromversorgungssystems betrug etwa 800 kg.
Hätte man Batterien verwendet, so wäre das Gewicht des Aggregats etwa zehnmal
so hoch gewesen.
Brennstoffzellen können vielseitig eingesetzt
werden. Man erprobt sie zur Zeit in Autos, Booten und Gabelstaplern. Sie werden
im militärischen Bereich als mobile Stromquellen verwendet und stehen auch als
Notstromaggregate zur Verfügung. Als einzige Großanlage existiert bisher eine
Anlage in New York mit einer Leistung von 4,8 Megawatt. Der notwendige
Wasserstoff wird durch Umsetzung von Erdgas oder Kohle mit Wasserdampf
hergestellt.
Im Gegensatz zu Akkumulatoren benötigen Brennstoffzellen keine
Ladezeiten, sie können kontinuierlich betrieben werden. Ihr Wirkungsgrad ist
etwa doppelt so hoch wie der eines Benzinmotors. Sie laufen geräuschlos und
sind umweltfreundlich. Die Ausgangsstoffe für eine Wasserstoff-Sauerstoff-Zelle
lassen sich leicht herstellen und stehen fast unbegrenzt zur Verfügung.
Allerdings liegen die Kosten für die Stromerzeugung noch weit höher als bei den
herkömmlichen Konkurrenten. Das liegt vor allem an dem noch sehr hohen Preis
für Wasserstoff.
Andere Brennstoffe
Grundsätzlich sind mehrere Alternativen zu
Wasserstoff als Brennstoff denkbar. Hydrazin (N2H4) ist
gut geeignet. Es ist bei Zimmertemperatur flüssig und bildet in Reaktion mit
Sauerstoff Produkte, welche die Umwelt nicht schädigen (Stickstoff, Wasser).
Hydrazin zählt allerdings zu den Krebs
erzeugenden Arbeitsstoffen, außerdem ist es sehr teuer. Es wird nur in der
Raumfahrt eingesetzt. In weiteren Versuchen wird auch Methanol als Brennstoff
erprobt.
In letzter Zeit geht die Forschung allerdings
noch in eine andere Richtung: Man versucht Brennstoffzellen mit einem festen
Elektrolyten zu entwickeln. Diese keramischen Zellen werden bei einer
Temperatur um 1000 °C betrieben. In ihnen könnten auch natürlich vorkommende
Energieträger wie Erdgas oder Erdöl umgesetzt werden. Ihr Wirkungsgrad soll
deutlich höher liegen als bei herkömmlichen Zellen.
2. Die Elektrolyse - eine erzwungene Redox-Reaktion
Prüft man Stoffe auf ihre Leitfähigkeit, so stellt
man fest, dass neben Metallen auch Salzschmelzen und Salzlösungen elektrischen
Strom leiten. Diese Stoffe enthalten bewegliche Ionen, man nennt sie Elektrolyte.
Bei Durchfluss von Gleichstrom zersetzen sich die Elektrolyte.
Die
Zerlegung eines Elektrolyten durch den elektrischen Strom nennt man
Elektrolyse.
Elektrolysen
sind endotherme Reaktionen. Die notwendige Energie wird in Form von
elektrischer Energie zugeführt und in chemische Energie umgewandelt.
Damit die chemische Reaktion bei der
Elektrolyse einsetzt, benötigt man eine Mindestspannung der Gleichstromquelle,
die Zersetzungsspannung. Oft beeinflussen Elektrodenmaterial, Temperatur und
die Art der abgeschiedenen Stoffe die Elektrolyse, und man muss eine höhere
Spannung als berechnet - die Oberspannung - zum Start der Elektrolyse anlegen.
Welche Vorgänge spielen sich bei der Elektrolyse ab?
Beispiel: Elektrolyse einer wässrigen
Kupfer(II)-chlorid-Lösung
Taucht man zwei
Kohleelektroden in eine CuCl2-Lösung und verbindet sie mit einer
Gleichstromquelle, so fließt ein Strom. An der positiven Elektrode, der Anode,
beobachtet man die Entwicklung eines gelbgrünen Gases; es handelt sich um
Chlor. An der negativen Elektrode, der Katode, entsteht Kupfer.
Kupferchlorid ist durch den elektrischen Strom in die Elemente Chlor und Kupfer
zerlegt werden.
Vorgänge an der Anode
Die
negativen Chlorid-Ionen wandern zur Anode. Sie besitzen im Gegensatz zum
Chloratom ein überzähliges Elektron. Dieses wird von der Anode aufgenommen.
Zwei Chloratome verbinden sich sofort zu
einem Chlormolekül. Man sieht, dass dem Chlorid-Ion bei der Reaktion ein
Elektron entzogen wird - es wird oxidiert.
2 Cl- ---> Cl2 + 2 e- Oxidation
Vorgänge an der Katode
Die positiven Kupfer-Ionen wandern zur Katode. Dort werden sie durch
die Aufnahme von Elektronen entladen - sie werden reduziert.
Cu2+ + 2 e- --> Cu Reduktion
Gesamtreaktion
2 Cl- + Cu2+ --> Cl2 + Cu Redox-Reaktion
In einer Elektrolytlösung befinden sich meist mehrere verschiedene
oxidierbare bzw. reduzierbare Stoffe. An den Elektroden reagieren die Stoffe
zuerst, die am leichtesten oxidiert bzw. reduziert werden. Auch das
Elektrodenmaterial kann reagieren, wenn kein Stoff in der Lösung vorhanden ist,
der leichter reagieren kann.
Beispiel: Elektrolyse von
verdünnter Schwefelsäure
Folgende Teilchen sind in der Lösung vorhanden:H3O+
Hydronium-Ionen, H2O Wassermoleküle, SO42-
Sulfat-Ionen.
An der Anode werden Wassermoleküle zu
Sauerstoff oxidiert, da sich die Sulfat-Ionen schwerer oxidieren lassen als das
Wassermolekül. An der Katode werden Hydronium-Ionen zu Wasserstoff reduziert.
Die verwendeten Platinelektroden sind an der Reaktion nicht beteiligt, da sie
nur sehr schwer reagieren.
Anode: 6 H2O
--> 4 H3O+
+ O2 + 4 e-
Katode: 4 H3O+ + 4 e- --> 4
H2O + 2 H2
Anwendung der Elektrolyse in Labor und Technik
Gewinnung unedler Metalle aus den Verbindungen
(Alkalimetalle, Erdalkalimetalle)
Reinigung von Metallen (z.B. Raffination von Kupfer)
Herstellung einiger Elemente (z.B. Chlor, Brom)
Herstellung metallischer Überzüge (z.B.
Galvanotechnik)
Quantitative Beziehungen
Die bei der
Elektrolyse geflossene Ladung Q berechnet man aus der Elektrolysedauer t
und
der Stromstärke I:
Q = I ∙ t
FARADAY stellte 1833
den Zusammenhang zwischen der abgeschiedenen Stoffmenge n
und
der geflossenen Ladung Q fest.
Die bei einer
Elektrolyse abgeschiedene Stoffmenge n ist der durch den
Elektrolyten geflossenen Ladung Q proportional: n ≈ Q.
So
wird durch die Ladungsmenge von 96 486 A stets ein Mol Silber-Ionen oder
anderer einwertiger Ionen abgeschieden. Ein Mol zweiwertige Ionen benötigt eine
doppelt so große Ladungsmenge. Insgesamt gilt der Zusammenhang: I ∙ t
= n
F
z. Als
neue Größen treten hier die FARADAY-Konstante F= 96 486 A ∙ s ∙
mol-1 und die Ionenladungszahl z auf.
2.1
Galvanotechnik
Chromglänzende Radkappen und Zierleisten am
Auto, vernickelte Hausschlüssel, versilbertes Besteck, verzinkte Schrauben für
den Heimwerker; verchromte Armaturen im Badezimmer und vergoldete Schmuckstucke
- man begegnet Produkten der Galvanotechnik überall im täglichen Leben. Aber
nicht allein aus Freude an glänzenden Oberflächen werden Gegenstände
galvanisiert. Meist geht es darum, Metalle durch eine Schicht aus einem
widerstandsfähigeren Metall vor Korrosion zu schützen.
Eine wesentliche Voraussetzung für gut
haltende galvanische Überzüge ist die sorgfältige Vorbehandlung der
Grundmetalle. Die Oberfläche wird mit Hilfe von Säuren von Oxidschichten
befreit. Sie muss mechanisch glatt poliert und mit organischen Lösungsmitteln
entfettet werden.
Beim Galvanisieren werden die Werkstücke in
eine Salzlösung des Überzugmetalls getaucht und als Katode geschaltet. Als
Anode dient ein Stück des Überzugmetalls, das sich bei dem Vorgang langsam
auflöst. Auf diese Weise bleibt die Konzentration der Ionen im Elektrolyten
konstant. Denn es gehen genauso viele Ionen in Lösung, wie an der Katode
abgeschieden werden.
Um gleichmäßige Metallüberzüge zu erhalten,
muss pro Zeiteinheit eine kleine, gleich bleibende Menge an Metall abgeschieden
werden. In galvanischen Bädern verwendet man deshalb häufig Lösungen von
Cyano-Komplexen des abzuscheidenden Metalls. Zwischen den komplex gebundenen
und den freien hydratisierten Metall-Ionen stellt sich ein Gleichgewicht ein.
[Ag(CN)2]- 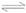 Ag+ + 2 CN-
Ag+ + 2 CN-
Die
Konzentration der hydratisierten Kationen ist dabei sehr klein. Sie wird
während des Galvanisierens konstant gehalten, da die verbrauchten Metall-Ionen
kontinuierlich durch den Zerfall des Cyano-Komplexes nachgebildet werden.
Eine interessante Anwendung des
Galvanisierens ist die Galvanoplastik. Mit Hilfe dieses Verfahrens lassen sich
maßgetreue Nachbildungen dreidimensionaler Gegenstände herstellen. Von dem
Original wird zunächst aus Silicon ein Negativ-Abdruck angefertigt, eine so
genannte Matrize. Dann wird Graphitpulver auf die Matrize gepinselt; die
Oberfläche des Siliconabdrucks wird dadurch elektrisch leitend. In einem
geeigneten Bad wird der Abdruck durch Galvanisieren mit einem Metallüberzug
versehen. Nach dem Entfernen der Siliconschicht liegt eine Kopie des Originals
vor, die noch weiter bearbeitet werden kann.
3. Korrosion - Redoxreaktion auf Abwegen
Jeder kennt das
Problem aus dem Alltag: Metalle verändern sich mit der Zeit, wenn sie Luft und
Wasser ausgesetzt sind, sie korrodieren. Fahrräder rosten, Wasserleitungsrohre
werden undicht, in Druckkesseln bilden sich Risse.
3.1 Arten der Korrosion
Die meisten dieser
Vorgänge lassen sich auf zwei grundlegende Arten der Korrosion zurückführen:
Bei der Säure-Korrosion werden Metalle durch Hydronium-Ionen oxidiert, es
bildet sich Wasserstoff. Bei der Sauerstoff-Korrosion wirkt Sauerstoff als
Oxidationsmittel, er wird zu Hydroxid-Ionen reduziert.
Säure-Korrosion
Viele Metalle sind
durch andere Metalle verunreinigt. So ist beispielsweise in technischem Zink
immer etwas Kupfer zu finden. Wenn dieses Zink mit CO2-hältigem
Wasser in Berührung kommt, bildet sich zwischen Zink und Kupfer eine
kurzgeschlossene galvanische Zelle, ein Lokalelement.
Der Vergleich der
Standard -Elektrodenpotentiale der beiden Metalle ergibt eine Differenz von
1,11 Volt. Das unedlere Zink geht daher an den Berührungsstellen zwischen Zink
und Kupfer unter Abgabe von Elektronen in Lösung. Diese fließen zum edleren
Kupfer und reduzieren an der Grenzfläche zwischen Kupfer und Wasser
Hydronium-Ionen, die sich durch die Protolyse der Kohlensäure gebildet haben.
Zn + 2 H+ ---> Zn2+ + H2
Die
Oberfläche des Zinks wird ständig abgetragen, sodass sich unter Einwirkung des
Elektrolyten auch weiter im Inneren Lokalelemente bilden und sich das unedlere
Zink im Lauf der Zeit auflöst.
Sauerstoff-Korrosion
Ahnlich
wie Zink korrodiert auch Eisen schnell, wenn es mit säurehältigem Wasser in
Berührung kommt. Entscheidend für die Zerstörung des Metalls in neutralen oder
alkalischen Lösungen ist jedoch der im Wasser gelöste Luftsauerstoff. Eisen
gibt Elektronen an den Sauerstoff ab, es entstehen Eisen(II)-Ionen, die im
Wasser gelöst werden. Edlere Fremdmetalle im Eisen oder auch Eisenoxid fördern
dabei die Elektronenabgabe.
Beim Rosten müssen also sowohl Sauerstoff als auch
Wasser vorhanden sein. Die Hydroxid-Ionen bilden sich bevorzugt in
sauerstoffreichen Zonen des Wassers, während die Eisen(II)-Ionen in
sauerstoffarmen Bereichen entstehen. Durch Diffusion treffen die
Eisen(II)-Ionen und die Hydroxid-Ionen aufeinander. Es bildet sich ein
Niederschlag aus Eisen(II)-hydroxid. Luftsauerstoff bewirkt dann die Bildung
einer porösen Rostschicht, die vor allem aus wasserhältigem Eisen(III)-oxid
besteht.
Es entstehen bei diesem Vorgang jedoch auch noch andere Eisenoxide,
z.B. Eisen(II, III)-oxid Fe3O4.
Die
Rostschicht kann das Eisen nicht vor weiterer Korrosion schützen, weil die
Stelle, an der das Eisen in Lösung geht, nicht mit dem Ort der Rostentstehung
identisch ist.
3.2
Korrosionsschutz
Durch Korrosion von Metallen wird die Wirtschaft von Industrieländern
erheblich geschädigt. Neben der Zerstörung der Metalle kommt es häufig auch
noch zu Folgeschäden: Produktionsanlagen fallen aus, wenn korrodierte Teile
ersetzt werden müssen, undichte Wasser- oder Gasleitungen führen zu
gefährlichen Unfällen. Öl läuft aus beschädigten Tanks aus und verschmutzt die
Umwelt. Überlegungen zum Korrosionsschutz sind daher nicht nur aus finanziellen
Gründen wichtig.
Überzüge
Man kann Metalle vor Korrosion schützen,
indem man sie mit einer Schicht aus einem korrosionsbeständigeren Metall
überzieht, die Luft und Feuchtigkeit fernhält. So werden Stahlbleche für die
Autoherstellung in eine
450 °C heiße Schmelze von flüssigem Zink getaucht (Feuerverzinken).
 An der Grenzfläche der
beiden Metalle bildet sich eine Zink-Eisen-Legierung. Die Stahloberfläche
erhält eine etwa 15 µm dicke Schicht aus Zink, die korrosionsbeständig ist, da
Zink an der Luft eine schützende Oxidschicht ausbildet. Energiebedarf und
Materialverbrauch sind allerdings relativ hoch.
An der Grenzfläche der
beiden Metalle bildet sich eine Zink-Eisen-Legierung. Die Stahloberfläche
erhält eine etwa 15 µm dicke Schicht aus Zink, die korrosionsbeständig ist, da
Zink an der Luft eine schützende Oxidschicht ausbildet. Energiebedarf und
Materialverbrauch sind allerdings relativ hoch.
Stahlbleche
lassen sich auch durch Elektrolyse verzinken. Dazu wird das Blech in eine
wässrige Zinksalz-Lösung gehängt und als Katode geschaltet. Als Anode dient
eine Zinkplatte. Bei einer Gleichspannung von 20 V entsteht eine etwa 5 µm
dünne Zinkschicht, die bei sorgfältiger Vorbehandlung der Stahloberfläche gut
auf dem Metall haftet.
Autos
können noch durch weitere Maßnahmen gegen Korrosion geschützt werden; etwa
dadurch, dass die Rohkarosserie eine Phosphatierstraße durchläuft. Zunächst
wird dabei die Metalloberfläche in einem Reinigungsbad von Schmutz, Öl und Fett
befreit. Das Auto gelangt dann in ein Tauchbad, das Phosphorsäure oder eine
Lösung von Hydrogenphosphaten enthält. Dabei bildet sich eine mit dem Metall
fest verbundene Schicht aus Eisen- und Zinkphosphaten, auf die dann der Lack
aufgetragen werden kann. In die Hohlräume von Automobilen wird flüssiges Wachs
eingespritzt, der Unterbodenschutz besteht meist aus Polyvinylchlorid (PVC).
Nichtmetallüberzüge spielen seit alters her eine wichtige Rolle beim
Korrosionsschutz. Römische Soldaten behandelten die Eisenrahmen von Katapulten
und Pfeilgeschützen mit Pflanzenölen. Auch heute werden Maschinenteile und
Waffen zur Pflege eingeölt. Durch Mischen von Minium (Pb3O4)
mit Leinöl erhält man eine gut deckende Anstrichfarbe zum Schutz von
Eisenkonstruktionen.
Bei einigen Metallen ergeben sich Überzüge an Luft auf natürlichem Weg.
Aluminium, Chrom und Nickel bilden ähnlich wie Zink dünne Oxidationsschichten
aus, die die Korrosion des darunter liegenden Metalls verhindern. Man spricht
von Passivierung.
Katodischer Schutz
Um die Korrosion von
Tanklagern, unterirdisch verlegten Rohren oder auch Erdölbohrtürmen im
Meerwasser zu vermeiden, verbindet man das gefährdete Metall elektrisch leitend
mit einem Metall, das sich leichter oxidieren lässt.
Aus
dem gleichen Grund werden an den Eisenteilen von Hochseeschiffen Zinkplatten
angebracht. Das unedlere Zink gibt über das Eisen Elektronen an Akzeptoren im Meerwasser
(z.B. Sauerstoff) ab. Der Anodenvorgang der galvanischen Zelle - die Oxidation
- findet also am Zink statt. Es löst sich langsam auf (Opferanode), das Eisen
bleibt unbeschädigt.
Quellen: Von der Chemie
Der große Brockhaus auf CD-ROM
Bertelsmann 2001 auf DVD
Internet: https://home.t-online.de/home/e-huber/Antr/Akku.html