Die Ionenbindung
Die
Ionenbindung entsteht durch die Anziehungskraft zweier unterschiedlich
geladenen Ionen
Ein Ion besteht aus einem oder mehreren Atomen und hat eine elektrische Ladung.
Ionen sind also elektrisch geladene Teilchen. Beispiele für Ionen sind:
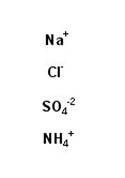
Positiv geladene Ionen nennt man Kationen, negativ geladene Anionen. Besteht
ein Ion aus nur einem Atom so gilt in der Regel folgendes: Metalle bilden immer
Kationen, Nichtmetalle bilden immer Anionen.
Wie entsteht
nun eine Ionenbindung?
Da alle Stoffe das bestreben haben den Edelgaszustand zu
erreichen (also die äussere Elektronenschale voll mit Elektronen zu besetzen),
tendieren Atome entweder eher dazu Elektronen abzugeben, oder Elektronen
aufzunehmen. Natrium hat z.B. ein Elektron auf seiner äußersten Schale. Es
liegt also nahe, dieses Elektron abzugeben um die Edelgaskonfiguration zu
erreichen. Chlor hingegen hat Sieben Elektronen auf seiner äußeren Schale. Um
die Edelgaskonfiguration zu erreichen (also acht Elektronen auf der äusseren
Schale zu haben), müsste ein Chloratom ein Elektron aufnehmen.
 Abb.1
Abb.1
Reagieren nun Natrium und Chlor miteinander, so gibt das
Natrium ein Elektron ab welches vom Chlor aufgenommen wird. So haben beide Ihre
äußerste Elektronenschale "voll gefüllt".
 Abb.2
Abb.2
Da ein Atom genauso viele Protonen (positiv geladenen
Teilchen) im Atomkern hat, wie es Elektronen (negativ geladene Teilchen)
besitzt, entsteht durch die Abgabe bzw. Aufnahme von Elektronen eine
Ladungsverschiebung. Normalerweise ist ein Atom nach außen hin elektrisch
neutral, da die positive Ladung (Anzahl der Protonen im Kern) gleichgroß ist
wie die negative Ladung (Anzahl der Elektronen in der Atomhülle).
Werden Elektronen abgegeben, so überwiegt nun die positive
Ladung der Protonen im Atomkern und das Ion ist elektrostatisch positiv geladen
(Kation). Es ist nach außen nicht mehr neutral geladen.
 Abb.3
Abb.3
Werden Elektronen aufgenommen so überwiegt die negative
Ladung der Elektronen gegenüber der positiven Kernladung und es entsteht ein
negativ geladenes Teilchen (Anion).
 Abb.4
Abb.4
Zum besseren Verständnis und zur Erklärung der Bilder,
übertragen wir obiges nun einmal direkt auf Natrium und Chlor.
Natrium hat 11 Protonen im Atomkern sowie 11 Elektronen in der Atomhülle, davon
eines auf seiner Aussenschale. Chlor hat 17 Protonen im Kern sowie 17
Elektronen in der Atomhülle, davon 7 auf der Aussenschale(Beides Abb.1).
Reagieren nun beide Partner miteinander so gibt Natrium ein Elektron an das
Chlor ab (Natrium ist nun ein Kation und Chlor ein Anion)(Abb.2). Beide
Reaktionspartner haben nun Ihre Ladung verändert. Natrium ist einfach positiv
(da nun 1 Proton mehr im Kern als Elektronen in der Atomhülle) geladen(Abb.3) und
Chlor ist einfach negativ geladen (da nun 1 Elektron mehr in der Atomhülle als
Protonen im Kern)(Abb.4). Da sich unterschiedliche Ladungen anziehen verbinden
sich nun das Natrium und das Chlor zu einer Verbindung, dem Natiumchlorid
(Kochsalz). Diese Verbindung nennt man Ionenbindung.

Obige Raktionsgleichung veranschaulicht wie ein Elektron sich vom Natrium löst
und vom Chlor aufgenommen wird. Als Produkte entstehen ein einfach positiv
geladenes Natrium-Kation und ein einfach negativ geladenes Chlor-Anion. Durch
die unterschiedliche Ladung ziehen sich die beiden Ionen gegenseitig an und
lagern sich zusammen zu einer Verbindung.
Diese zusammenlagern durch gegenseitige Anziehung aufgrund unterschiedlicher
elektrostatischer Ladung nennt man Ionenbindung.
Da die Gegenseitige Anziehung in alle Richtungen gleich stark wirkt umlagern
sich Natriumionen ringsherum mit Chlorionen und Chlorionen umlagern sich
ringsherum mit Natriumionen. Jedes Chlor umlagert sich mit gleich vielen
Natrium-Ionen nd jedes Natrium umlagert sich mit gleich vielen Chlor-Ionen. So
entsteht ein geordneter Aufbau in dieser Verbindung. Es bildet sich ein
sogenannter Kristall mit der typischen Kristallstruktur. Die Energie die dabei
freigesetzt wird, nennt sich Gitterenergie.
Typische Eigenschaften einer Ionenbindung sind ist das
Ionengitter (würfelförmig aufgrund der Anordnung von Anion und Kation), der
hohe Schmelzpunkt aufgrund der Stärke des Ionengitters, Nichtleiter im festen -
Leiter im geschmolzenem bzw. gelösten Zustand und die sprödigkeit, da durch
ausgeübten Druck eine Lage des Ionengitters gegen eine andere verschoben wird
und so gleichartig geladenen Ionen aufeinander liegen, welche sich voneinander
abstoßen.
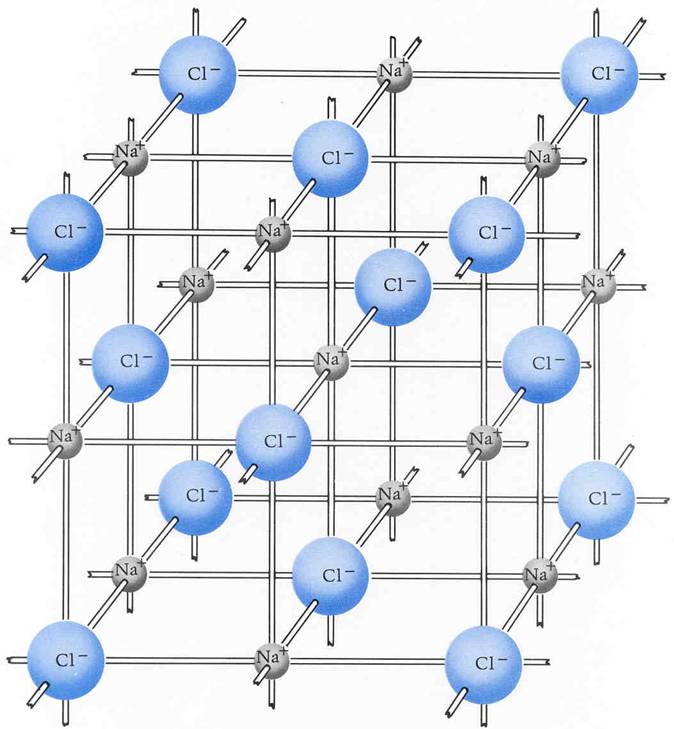 Abb. 5
Abb. 5
Abbildung 5 Zeigt das Ionengitter (die Kristallstruktur)
von NaCl.


 Abb.1
Abb.1 Abb.2
Abb.2 Abb.3
Abb.3 Abb.4
Abb.4
 Abb. 5
Abb. 5