Referat Bindungsarten
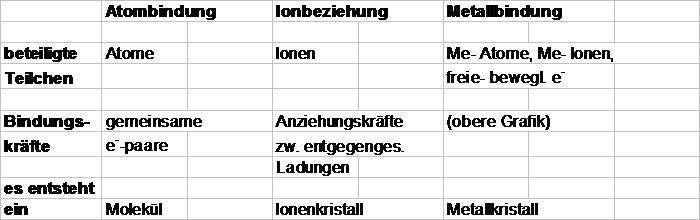
Bindungsarten
Grundlagen aller
Stoffe = Teilchen
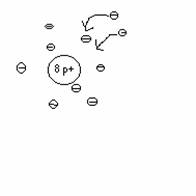
z.B. Sauerstoff- Atom
| | | | |
|
Elektronen in der Atomhülle
|
|
|
| |
|
|
| |
|
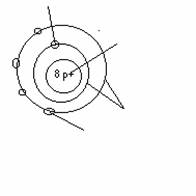
Anzahl p+ = Anzahl e-
Atome sind
elektrisch neutral
|
|

Jedes Atom ist
bestrebt, einen stabilen Zustand zu erreichen, d.h.
entweder
eine 1. Schale (gilt nur für die Elemente 1- 5)
oder 8
Außenelektronen
'Gegenseitiges
Borgen' e-
aufnahme oder e- abgabe
von
Außenelektronen
z.B.
Sauerstoff
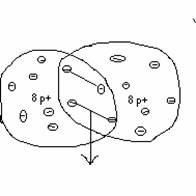
 gemeinsame Elektronenpaare, 8
p+ Entstehung eines 2- fach
negativ
gemeinsame Elektronenpaare, 8
p+ Entstehung eines 2- fach
negativ
umkreisen
beide Atomkerne 10 e- geladenen Teilchen
 Entstehung
eines neuen
Entstehung
eines neuen
Teilchens =
Ion
(Oxid- Ion)
=
Molekühl -
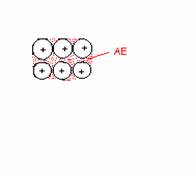
entgegengesetzte
Ladungen der Ionen führen zu
 starken Anziehungskräften zwischen den Ionen
starken Anziehungskräften zwischen den Ionen
 Ionen
ordnen sich regelmäßog in
Ionen
ordnen sich regelmäßog in
Atombindung einen
Ionenkristall
Ionenbeziehung

 Atombindung
Atombindung
- etwa gleichgroße Atome üben - unterschiedlich Große
Atome
fast gleichstarke
Anziehungskräfte üben unterschiedliche
auf die gemeinsamen
Atompaare aus Anziehungskräfte aus
 Atome werden etwa gleich Das
größere Atom
Atome werden etwa gleich Das
größere Atom
Häufig
umkreist wird
häufiger
Umkreist
 Bildung eines
Dipols
Bildung eines
Dipols
=
unpolare Atombindung =
polare Atombindung
Die
Bindungsart läst sich mit Hilfe des Elektronegativitätswert bestimmen.
Elektronegativitätswert bestimmen
Differnz ermitteln
Mit Grenzwerten vgl.
Grenzwerte:
Größer
1,7 = Ionenbeziehung
größer
oder gleich 1,7 = Atombindung
bei
Atombindung: größer 0,4 = polare
AB
kleiner oder
gleich 0,4 = unpolare AB
z.B. MgO
Mg = 1,2
O = 3,5
3,5 - 1,2 = 2,3
2,3 = Ionenbeziehung
Bindungen in Metallen = Metallbindungen
Metallatome besitzen relativ wenig AE
nur geringe Anziehungskräfte zwischen AE und 'ihrem'
Atom

 Me- Atom Metall-
Ion + AE´s sind leicht
verschiebbar
Me- Atom Metall-
Ion + AE´s sind leicht
verschiebbar
e-
Wechselwirkung
zwischen
 Me- +Ion Metall-Ion Metall- Atomen
Me- +Ion Metall-Ion Metall- Atomen
Metall-
Ionen
 freie-
bewegl. e-
freie-
bewegl. e-
=
Bindungskräfte
Zusammenfassung: