BLEI: Vorkommen:
Pb-Sulfid, -carbonat,; Endprodukt des Uranzerfalls( Pb208/Pb204,) Blei
hat bestimmtes Isotopenmuster( → je nach Ausgangsprodukt) im
Massenspektrometer untersucht.
Isotopenmuster verrät Herkunft →
Kriminaltechnisch (Blei in Kugel).
Pb wird aus Salzen reduziert. PbS wird
oxidiert: an der Luft erhitzen: Rösten → PbO ;
½ PbS + PbO →∆
SO2 + Pb
Werkblei: grob + verunreinigt
Pb mit Luft durchblasen → Arsen,
Antimon, Zinn reagieren + schwimmen am Blei als Schlacke.
Seigern: Absinken
intermetallischer Verbindungen. → Pb(verunreinigt mit Silber).
Parkesieren:
Extraktionsverfahren mit fl. Zink. Pb + Zink haben Mischungslücken. 100 kg Pb +
1 kg Zink geschmolzen mischen sich nicht, aber Silber reichert sich im Zink an.
Zink verdampft bei 900°C → Silber bleibt (95%). Rohsilber: HNO3-Bad
als Anode, geht in Lsg. und sondert sich an der Kathode ab. (elektrolyt.
Raffinierung).
Pb ist härter als Zinn, bläulichgrau, frische
Oberfläche glänzend→dann grau; ρ=11,3g/cm3, SP: 327°C.
 Beständig gegen
Luftfreies H2O: Pb + H2O + ½ O2 → Pb(OH)2.
Für Abwasserrohre nicht aber für Trinkwasserrohre. Stabil gegen oxidierende
Säuren (z.B.: HNO3). MINUS PLUS
Beständig gegen
Luftfreies H2O: Pb + H2O + ½ O2 → Pb(OH)2.
Für Abwasserrohre nicht aber für Trinkwasserrohre. Stabil gegen oxidierende
Säuren (z.B.: HNO3). MINUS PLUS

 Verwendung: Pb-Akkus
→ Autos.
Verwendung: Pb-Akkus
→ Autos.
I.


 Pb + SO42-
→ Pb2+ + 2e- + SO42- →
PbSO4
Pb + SO42-
→ Pb2+ + 2e- + SO42- →
PbSO4
II.
PbO2+ 4 H+ + SO42-
+ 2e- → PbSO4 + 2 H2O

 Pb0
+PbO2 + 2 H2SO4 → 2 PbSO4 + 2
H2O + Energy
Pb0
+PbO2 + 2 H2SO4 → 2 PbSO4 + 2
H2O + Energy

 Aus Pb0 +
PbIV → PbII
Aus Pb0 +
PbIV → PbII
Pb
PbO2
 →
Konzentration der Schwefelsäure = Wie stark geladen
→
Konzentration der Schwefelsäure = Wie stark geladen
Beim Entladen wird H2SO4
verdünnt
→in etwa 1000 Ladezyklen; mechan.
Alterungsvorgänge → Pb wird nicht mehr so angelagert wie vorher!
→ Billigste Methode Strom zu speichern
→ Nachteil: groß und schwer.
II-wertige Verbindungen: PbCrO4
Verwendung als rotes Bleipigment → Gesundheit: im Knochen gelagert →
Schmerzen → Entfernung durch Vit. C; Nachteile für ZNS.
IV-wertige Verbindungen: im Benzin als Antiklopfmittel
(Pb(Ethyl)4) in Promille = Radikalfänger: saugt freie e-
auf → keine vorzeitige Zündung. Kleine Mengen Blei werden frei →
Als Schmiermittel verwendet. Zusatz: Ethylbromid, damit Pb nicht im Motor
bleibt: Pb-Bromid durch Auspuff.
Jetzt Kat.: Pb beschädigt diesen →
keine Bleizugabe mehr. Damit Benzin vollständig verbrennt, sodaß kein
unverbranntes Benzin frei wird. Al2O3 Block + feine
Bohrungen überzogen mit 1-2 g Iridium/Platin → große Oberfläche. →
durch Auspuffgase erhitzt: Luftüberschuß im Auspuffgas verbrennt Benzin am Kat
zu CO2 + H2O.
Es gibt viele Katgifte: blockieren Oberfläche
z.B.: Pb, S.
Jetzt gegen Klopfen: Benzol bis zu 5 % →
Leukämie; gefährlich für Kinder → Benzol sinkt zu Boden. → Es
bleibt beim Raffinieren über: → im Labor im Giftschrank. Ester oder
Alkohole statt Benzol in USA im Einsatz: Verlust von 3-4% Effektivität.
Pb3O4: Pb2[PbO4] Spinell, Menninge → Rostschutz für
Brücken + Eisenkonstruktionen → Es geht kein Pb in Lösung. PbCrO4
ist rot, PbO als Malerweiß → geht leicht in Lösung → gibt Blei
leicht ab. statt dessen TiO2.
Plumbat: Blei kommt in
Verbindungen als Anion vor. PbO2 starkes Ox-Mittel.
Bleisulfid / -glanz: schwere, schwarze,
glänzende Kristalle.
Plumban: PbH4
schweres giftiges Gas. Mit H2O: Pb(OH)4 + PbO
SAUERSTOFF: Chalkogene
Erzbildner. Zu 20 % in Luft aus Photosynthese. Licht: Spaltung
von H2O durch Chlorophyll / Licht. 2 H2O → O2
+ H wird an Red-Aquivalent gebunden, durch schwache chem. Verbindung gebunden.
H-Gas schlecht handhabbar.
Dunkel: [H]-R-CO2
→ Kohlehydrate, O2 wird abgegeben: O ist Gift für Pflanzen.
Früher 30% CO2 in Atmosphäre →
jetzt 0,03 % weil als CaCO3 in Gebirgen.
O2: Diradikal; Oxidiert
alles. Organische Substanzen altern, Metalle rosten. Mensch erzeugt durch
Atmung 1 l H2O → gebundener H + O2 , C wird zu CO2
verarbeitet. H2O verdunstet.
Viel Sauerstoff in Erdkruste(oberste 16 km +
Meere + Atmosphäre). Häufigstes Element → Gebunden! in Gesteinen: SiO2,
-CO3, Granit, Gneis, Kalk, H2O. Lithosphäre schwimmt am
flüssigen Fe-Kern → Isoliert.
O2-Gewinnung 1) Aus der Luft (Abtrennung von CO2,N)
2)
aus H2O (Elektrolyse)
Ad 1) LINDE-Verfahren
/ Joule-Thomsoneffekt
Luft ist reales Gas → kühlt sich bei
Expansion ab. Gas komprimieren → wird wärmer. Drossel Engstelle. Wärme in
Kühlwasser abgegeben. Gas breitet sich hinter Drossel wieder aus und kühlt
zusätzlich ab. Gekühlte Luft wird als Vorkühlung für komprimiertes Gas
verwendet. In mehreren Zyklen kühlt es immer mehr ab. Irgendwann bilden sich
Tropfen. Expansion → Moleküle bewegen sich auseinander → bewegen
sich langsamer → Abkühlung.
Flüssige Luft wird destilliert O2,N2,Ar
Siedepunkt von O2 höherer
Siedepunkt, N2 verdampft als erstes. Flüssiges O2: blau.
Sauerstoffflaschen nie mit fetten Händen öffnen → Explosionsgefahr.
Nutzung:→ LD-Verfahren.
(Stahlerzeugung)
→ zum Schweißen, Schneiden, + Acetylen
/ H
→ Medizin:
Beatmungsgas. reines O2 ist nur kurz verträglich, 1-2 Tage →
Lungenoberfläche wird gereizt und
geschädigt.
Hämoglobin: transportiert O2,
Fe ist immer 3-wertig., flaches Häm-Molekül + kugelförmiges Eiweiß. Stärke der
Komplexbildung ist abhängig vom PH-Wert, im sauren schwächer. O2 soll
bis in die Zellen (Mitochondrien) transportiert werden. Je weiter Blut in den
Körper vordringt, desto leichter wird es abgegeben, wegen saurem Milieu des
Blutes durch Stoffwechselprodukte.
Im Muskel: O2
wird vom Hämoglobin ans Myoglobin abgegeben, erst das dringt in Zelle ein.
Niere und Hirn sind Hauptverbraucher des O2. In der Atemkette wird O2
mit H verbunden [in Mytochondrien durch Cytochrome (z.B.: Cytochrom C)]
Knallgasreaktion läuft in
mehreren Schritten ab ( = Atemkette) bei jedem Schritt wird kleine Energiemenge
frei. ADP → ATP(eigentlicher Treibstoff des Körpers).
Andert Fe seine Wertigkeit auf 2: Methämoglobin kann
keinen O2 transportieren. Kleiner Anteil ist immer vorhanden, ca.
1%, aber er kann durch Nitriteinnahme steigen. Methäm: 10-20% → Kinder
bleiben zurück. Verhältnis Körpergewicht zu O2-Aufnahme.
CO2 tauscht mit O2
im Hämoglobin in Lunge. CO bindet sich stärker am Häm → Vergiftung.
Langsames Rauswaschen mit Druck-O2. Raucher: 10% des Häm gebunden →
mehr rote Blutkörperchen werden produziert: Fließfähigkeit leidet →
kleine Gefäße verstopfen leichter.
20 l/h O2 braucht
der Mensch in Ruhe.
π* π* Triplett O2

Triplett-O2 kann durch
Energiezufuhr in Singulett-O2 überführt werden (UV,
Photosensibilatoren: Eosin, Methylenblau).
π* π* π* π*
Nach mehr Energiezufuhr unterschiedlicher
Spin. Angeregter O2 ist aggressiver + reaktionsfreudiger.
Im H2O gelöste Luft hat 3-4 mal so
hohen Anteil an Singulett-O2:
pos.: für Fische: kommen mit weniger O2
aus
neg.: Metallteile rosten im H2O
schneller.
Angeregter O2: kann Zellen
zerstören. Dismutasen machen die gefährlichen O2
unschädlich(schnellsten Enzyme). Als entzündungshemmende Substanz. (muß
gespritzt werden); weiße Blutkörperchen (Leukozyt) bringt Bakterium mit HCl
oder O3 um (Cl, O2).
Alterung ist zum Teil durch O2
bedingt.
Pflanzen haben Schutz: Carotin → gelb,
wenn Chlorophyll verschwindet Gelbfärbung der Blätter im Herbst.
 Verbindungen: O2- Oxid: CaO OZON: O+
Verbindungen: O2- Oxid: CaO OZON: O+
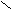

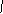 O22-
Peroxid O O
O22-
Peroxid O O
O2- Hyperoxid
O3- Ozonid
O2+ Dioxigenyl gegenüber Fluor
Ozon: aus O + O2;
O2 wird gespalten in O; dazu ist viel Energie notwendig. (Thermisch,
geht aber schlecht; starkes UV + Photosensibilatoren; für Praxis: Siemens'scher
Ozonator- verspiegelte Röhre.
Spannung 3000 V. O2 → O2
+ O3. Man bekommt bis zu 15% Ozon.
Ozon zerfällt rasch wieder. Zum desinfizieren
von Trink- und Abwässern. Muß an Ort und Stelle produziert werden.
Ozon wird auch zum bleichen von Papier, und sterilisieren im
Krankenhaus verwendet.
Bodennahes Ozon als Gas
aggressiv
O2 + NO2 → NO + O3
Stickstoff wirkt als O2 -Überträger. Normal Gleichgewicht auf der
linken
Seite. Funktioniert wenn
NO-Moleküle entfernt werden → Radikalreaktionen. Teilstoffe für O3 kommen
aus der Natur: N2O (Lachgas → Wiese), Terpene, CH4,
→Ozonbelastung ist von
Sonneneinstrahlung abhängig. Ozonwolke aus der Stadt steigt auf und wird
weitergetragen durch Wind → Erhöht sich das Land kommt es zur Berührung
an Erdoberfläche. → Gefährlich für Pflanzen und Tiere.
Ozon in Stratosphäre: Schützt Erde vor
UV-Licht.(190-254nm).
O2
→UV 2 O0
H2O
→ UV H2↑ + O0
Luftdichte
ändert sich mit der Höhe, Alle 5500 m ändert sich Luftdichte um die Hälfte.
O2
→ 2O0 O3
filtert UV-Licht.
O2
+ O0 → O3 240 nm wird von O3 gefiltert.
Im Körper: H2O →UV
OH. reagieren mit Gewebe → Zerstörung.
→ Erstes Leben kann sich nur im Wasser
entwickelt haben → weil UV-Filter.
O3 ist nicht beständig wenn
oxidierbare Stoffe vorhanden, es hat längere Lebensdauer als das bodennahe
Ozon.
Je höher die Luftschicht, desto größer ist
die Lebensdauer des O3. Die Ozonmenge ist in den Schichten gleich,
aber die Konzentration steigt im Vergleich zu den Luftmolekülen nach oben hin.
FCKWs:
Fluorchlorkohlenwasserstoffe. Verschiedenster Molekülbau + unterschiedliche
Siedetemperatur, je mehr Fluor, desto stabiler. Sie haben sehr ähnliche
Eigenschaften., sehr beständige reale Gase, ungiftig, nicht brennbar,
geruchlos, chem. Widerstandsfähig, auch als Feuerlöscher verwendbar: verdrängen
Luft. Schwerer als Luft = Halone(besonders große Moleküle.)
In der Stratosphäre: F0, Cl0
Normale KWs werden
in der Troposphäre chemisch umgesetzt, oxidiert durch O3-Einfluß,
hartes Licht. Freone (FCKW) sind aber so
beständig, daß sie bis in die Stratosphäre gelangen und dort vom UV-Licht zu
Radikalen werden. Es kommt zu photochem. Reaktionen: Sauerstoffkonzentration
nimmt ab → Es wird weniger O3 gebildet. Cl0, F0
reagiert mit O0.
Ozongehalt wird in
Dobson-Units gemessen. [mg O3 / m2]. Praktisch mit
Luftproben aus Ballonen. Naßchemisch: I- + O3 → O2
+ I (Farbreaktion).
China, Indien verwenden noch FCKW (billig).
Ersatz: Propan, Nachteil: brennbar.
Verwendung von O3: Strukturanalyse
(statt Kernresonanz)
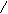
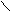 -C=C- + O3 → -C - O - C- Molozonid
-C=C- + O3 → -C - O - C- Molozonid
O-O
Verwendung von FCKW: Als Treibgas (bei
Spraydosen), in Kühlschränken, Feuerlöscher
Ersatz durch Propan.
Narkosegas: stark fluorierte KW lösen sich
in Fettmasse (Gehirn) und stören Impulsübertragung der Nervenzellen. →
weil FCKW ein Stoff ist der durch Stoffwechsel nicht angegriffen wird →
Keine schädlichen Abbauprodukte.
4 Phasen der Narkose:1.Euphorische
Phase,2.Excitationsphase: Körper spürt Schmerz ist aber
Bewußtlos.,3.Schmerzempfinden sinkt,4.verlängertes Rückenmark (Atmung,
Herzschlag setzt aus). Für längere Narkose, maschinell beatmet (mit Gemisch aus
O2 + Luft + N2O, Halothan, Fluothan. Schwere Edelgase:
(Krypton: Bestes Narkosemittel, fettlöslich → sehr teuer: muß
wiedergewonnen werden).
O-VERBINDUNGEN:
H2O: Von woher?
Theorien: Durch Meteoriten (meist staubiges Eis).
Erstes Leben im Wasser → UV-Schutz. Meer: 3½% Salz (1%KCl)
Urmeer 0,9%;
Größtes Süßwasserreservoir: Polkappen →
Es kann nur reines Wasser zu Eis werden→Konzentration im übrigen Meer
steigt.
Trinkwasserknappheit: Entsalzung von
Meerwasser: Umkehrosmose sehr teuer.
Deionat: Ionenaustauscher:
Kugeln aus organischen Polymeren. Anionenaustauscher: Harz+Hydroxylammingruppen
-N-H -OH- ; Kationenaustauscher: Harzkugel+Sulfonsäure -S -OH+.
Über elektrische Leitfähigkeit wird der Wirkungsgrad gemessen → wenn
Leitfähigkeit steigt sind mehr Ionen im Wasser. Regenerieren: Spülen mit HCl
(Kat.), Spülen mit Lauge (Ani.).
CaNO3 → HNO3 über
Kationenaustauscher.
Vom Salz zur Säure über Kationenaustauscher.
Kationenaustauscher: Immobilisierte
Sulfonsäure = hochpolymer, bleiben an Kugeln haften.
Austauscher: für gezielte
Trennungen von komplizierten Gemischen. z.B.: Abfall aus AKW→
verschiedene Kationen werden festgehalten, dann wird der Kationenaustauscher
mit Pufferlösungen (versch. pH-Werte) gewaschen - bestimmte Kationen gehen
wieder in Lösung.
Anionenaustauscher: organische Basen
herstellen. Für Medizin zur Senkung des Cholesterinspiegels. Unterbricht
Kreislauf von Galle-Fettemulgation und Rückresorption, Spiegel im Blut sinkt.
Destilliertes H2O: besser als
Deionat, bidestilliert für Medizin. Kochendes H2O löst Glas
oberflächlich → für Destillation ist es besser Quarzapparaturen zu
verwenden. Noch besser Apparate aus Silber = Leitfähigkeits-H2O (=
fast vollständiger Isolator).
Blaues H2O: Spiegelung des
Himmels, geringe Blaufärbung durch Schwingungsoberwelle. Oberwellen sind
sichtbar. H2O-Moleküle schwingen verschieden. Unsymmetrische
Schwingung.
Wasser hat hohe Schmelz und
Verdampfungsenthalpie: → guter Wärmepuffer für Erde
(Tag-Nacht-Ausgleich).
Anomalie: Bei 4°C geringste
Dichte. → Sickert in Gestein und bei weiterer Abkühlung dehnt es sich aus
und sprengt ihn.
Polarität: Messung durch
Dielektrizitätskonstante: Kondensator zwischen Leitern. Kondensator mit H2O
als Dielektrikum und Vergleichsweise mit Vakuum. H2O kann 72 mal
mehr Strom speichern. Nur durch starke Polarität flüssig. →
Wasserstoffbrücken!
Mensch benötigt ca. 2 L H2O pro
Tag. Zu wenig H2O führt zur Hyperthermie → Nierenversagen.
H2O2: gewinkeltes
Molekül. viel viskoser als H2O. Als Perhydrol im Handel: 30%.
Vorsichtig Destillieren: → 100% explosiv.
3 Verfahren zur Herstellung:
Brinnsches Verfahren
BaO2 + H2SO4
→ BaSO4 + H2O2
Elektrolyse von H2SO4: An Anode entsteht
Peroxoschwefelsäure HSO4-OH
3. Anthrachinonverfahren: H2O2
mit H2O herausextrahieren.
OH O
 +
O2 →
+
O2 →
OH O
Mit H + Balladium
wieder reduziert in Schwerölbasis
Nutzung: Borate umgesetzt zu Naperborat als
Bleichmittel in Waschmitteln / Papier. In USA und Japan: Na2CO3.H2O2
als Bleichmittel → ist aggressiv. Weil weniger mechanische Beanspruchung
durch Bottichwaschmaschine. Japan: Kaltwasser.
H2O2 verdünnt als
Desinfektionsmittel 3%. In Kontaktlinsenlösung. H2O2
zersetzt sich schnell (Zugabe von Schwermetallen und Laugen) →
Stabilisatoren: EDTA bindet Schwermetalle. Abfüllung in Plastikflaschen,
Phosphorsäure in geringen Mengen.
Nachweis für Peroxide: TiCl → Bildet
Komplexe H-O-TiO2 leuchtend gelb.
Anwendung: destillieren
organ. Substanz z.B. Ether (bildet leicht Peroxide durch Licht beim Destillieren
→ Zerstörung mit Braunstein.
SCHWEFEL: S8 Kronenform
Vorkommen: Als Sulfid: CuS, BaS, FeS2(Pyrit),
PbS, ZnS, FeS
Als
Sulfate: CaSO4(Gips), BaSO4(Schwerspat)
In Eiweißverbindungen:
(Schwefelbrücken z.B.: Haare nicht H2O löslich. → hochpolymer,
für Dauerwelle: S-Brücken gebrochen, in Form gebracht + geschlossen.)
Schwefellagerstätten oft neben Erdöl weil es
Schwefelhaltige Produkte enthält. → Abtrennung aus Erdöl. →
Gewinnung.
H2S +Ox →
SO2 + H2S → S8 + H2O
Vorkommen aus elementarem S in USA:
Einschlüsse im Gestein. Durch H2O-Dampf wird dieses Herausgelöst
indem es ausschäumt.
Verwendung: 1. Vulkanisieren von Reifen; Festigkeit der
organ. Polymere.
2. für H2SO4:
eine der meistverkauften Chemikalien.
3. Schwefelmilch: CS2 löst S → in
Wasser kollodiale Lösung. Im Weinbau als Spritzmittel gegen Pilze. In der
Dermatologe: Cremes (Feinverteilung) gegen Pilze.
4. Feuerwerkskörper und Zündhölzer.
Schmelzen von S: S8 rhombisch
(α) →100°C: monoklin (β) → flüssig (γ) S8-Ketten
brechen. Bei 440°C verdampft S8. Atomares S: 2000°C
NaS-Batterie: bester Akku.
Elektrolyt ist fest. Na und S-Elektroden sind flüssig. ~300°C Betriebstemp.



 Na0
Na0
 2 Na → 2Na2+
+ 2e- Na-Aluminat
2 Na → 2Na2+
+ 2e- Na-Aluminat
 3/8 S + 2e-
→ S32- S80
3/8 S + 2e-
→ S32- S80
10-fache Menge an Strom speicherbar im
Vergleich zu Pb-Akku, und mehr Ladezyklen ~10 Jahre.
Sulfide: Salze aus H2S
(schwache Säure) + Schwermetalle
S-Verbindungen:S-Halogenide: SF6: sehr stabil als
Einziges. Gas mit hoher Dielektrizitätskonstante als Dielektrikum für Transformatoren.
SCl2,
SOCl2(Thionylchlorid), SO2Cl2
(Sulfonylchlorid). → verdampfen leicht, stechender Geruch, ätzend, hydrolysieren in
H2O.
 CH3
CH3
 O=S Dimethylsulfoxyl DMSO →Universallösemittel:
löst Salze, H2O, Fette
O=S Dimethylsulfoxyl DMSO →Universallösemittel:
löst Salze, H2O, Fette
CH3
kann durch Haut diffundieren →
Transdermal.
Verwendung: Salben → als Schlepper:
bringt Substanzen, die nicht von allein in die Haut gelangen hinein.(Nikotin,
Hormone,).
Schwefeloxide: entstehen bei Verbrennung: SO2
(Ausschwefeln von Fässern).
Saurer Regen durch
minderwertige Braunkohle; Fällung mit Fe(OH)2 = Luxmasse in
Schornsteinen. Schädigt Spaltöffnungen bei Pflanzen. SO2-Anteil
hauptsächlich Vulkanischen Ursprungs.
H2SO4-Gewinnung: Kontaktverfahren: Vanadiumpentoxidkat. + Luft
aus SO2 → SO3 + Wasser → H2SO4
(Oleum) → teuer.
Bleikammerverfahren:
Salpetersäure + Luft +SO2 → H2SO4.
Flüssiges SO2: Ahnliche
Eigenschaften wie H2O; H2O-frei nicht sauer →
Lösemittel.
H2SO4 aus SO3
(Anhydrid) + H2O O O
H2SO3 aus SO2
(Anhydrid) + H2O ║ O ║
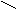
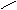
 DiH2SO4
→ H2S2O7 O=S S=O
DiH2SO4
→ H2S2O7 O=S S=O
│ │ O O
OH OH ║ ║
 H2S2O4
Dithionsäure (Dithionate) O=S-S=O
H2S2O4
Dithionsäure (Dithionate) O=S-S=O





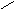 │ │ OHOH O O O
│ │ OHOH O O O
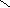
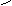
 H2S2O4
Dischwefelige Säure aus 2H2SO4-H2O = H2S2O4
S S
H2S2O4
Dischwefelige Säure aus 2H2SO4-H2O = H2S2O4
S S
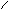


 O O OH OH
O O OH OH
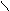
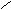 Dithionige Säure S-S
Dithionige Säure S-S
Salze: Dithionite OH OH


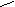 Thioschwefelsäure
unbeständig aber Salze wichtig → Fixiersalze: Na2S2O3
(Natriumthiosulfat löst AgCl, AgBr,.) O OH O O
Thioschwefelsäure
unbeständig aber Salze wichtig → Fixiersalze: Na2S2O3
(Natriumthiosulfat löst AgCl, AgBr,.) O OH O O
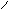

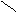 Peroxoschwefelsäure: S Peroxodischwefelsäure: ║ ║
Peroxoschwefelsäure: S Peroxodischwefelsäure: ║ ║
O OOH OH-S-O-O-S-OH
║ ║
O O
Caro'sche Säure: H2SO4
kochen, mehrere verschiedene Säuren sind enthalten.
Polythionsäure: Wie Dithionsäure
nur mehr S.
alle Thione S-S-Verbindungen für Waschmittel.
Verwendung: Geschirrspülmittel, Düngemittel
(Ammonsalze), Kunstfasern, Farben, Pigmente
Peroxoschwefelsäure: H2SO5
Teil der rauchenden H2SO4.
Fotographie: Trägerschicht aus
Nitrocellulose → feuergefährlich. Heute aus Polycarbonat + Gelatine
(enthält Lichtempfindliche Kristalle aus AgBr + Licht → Br0 +
Ag0)
Es entstehen Fehlstellen im Kristall.
Entwickler (Red-Mittel) z.B.: Hydrochinon. Alle Ag+ zu Ag.
Belichteter Kristall braucht 5-15 min. um zu reagieren. Unbelichtetes bräuchte
länger → Vorher Abbruch. AgBr + 3 Na2S2O3
→ [Ag(S2O3)3]Na3 + NaBr.
Löslicher Komplex wird herausgewaschen. Nur blaues Licht ist stark genug um e-
herauszuschlagen→rotes Licht in Dunkelkammer. In Suspension noch
Photosensibilisatoren enthalten. Empfindlichkeit des Kristalls hängt ab von
Größe der Kristalle → je größer umso empfindlicher. hochempfindlicher
Film → schlechtere Auflösung.
Farbfilm in Schichten sensibilisiert.
Röntgenbilder sind 2seitig beschichtet.
Latentes Bild: Das zu entwickelnde
Bild. Dort wo belichtet wurde Ag0. Bild noch nicht haltbar →
Fixiersalz Na2S2O3.
Fixieren: Nicht entwickelte, feste
Silberhalogenide reagieren mit Salz zu einem Komplex [Ag(S2O3)3Na3
+ NaBr. Komplex ist wasserlöslich und nicht mehr fest → AgBr wird
herausgewaschen.
Wassern: Alle Reste
wegwaschen, je besser gewassert wurde, umso länger ist Bild haltbar.
Schwefel-N-Verbindungen: R-SO3H
Sulfonsäuren (→ Ionenaustauscher) sauer wie H2SO4
aber nicht H2O anziehend. Bei langkettigen R-SO3Na →
Waschmittel.
NH
R-S-OH Sulfonammid: Antibakteriell. Jetzt Penicillin (wirksamer).
NH
Thermochrome: Andern bei Temperatur ihre
Farbe. reversibel und irreversibel.
SELEN: selten, ähnlich S,
mehr metallisch. Vorkommen: FeSe, CuSe
Pflanzen: Selenbeständig(SeO) in Meeresnähe.
Wenn nicht gedeihen sie schlecht.
Hefe: Nimmt Se auf → getrocknet als
Tablette, reines SeO nutzlos. Im Körper Schutzmittel gegen Entstehung von
Krebs, sonst toxisch.
SeO: Als
Antischuppenmittel in Shampoos
Verwendung als Metall: reagiert auf Licht
(photoelektr. Effekt).
Es lädt sich auf: 1.
Xerox-Verfahren für Kopierer: Selentrommel aufgeladen → durch Belichtung
Entladung → Farbpartikel werden aufgenommen.
2. Als Photozelle →
Belichtungsmesser. CdS genauer.
3. Gleichrichter von
Wechselstrom.
4. Lichtschranken.
Verschiedene Modifikationen: grau, rot,
amorph, teils metallisch, meist Halbleiter.
Selen bildet Anionen: H2SeO3
Selenige Säure → Na2SeO3 Selenide
TELLUR: Analog Selen; sehr
selten.
POLLONIUM: Von Marie Curie
entdeckt. Aus 1000 kg Uranpechblende → 30 mg
STICKSTOFFGRUPPE: [N]: 1s2
2s2 2p3
NGas
ArsenHalbmetall
BismutMetall
STICKSTOFF: 78% Luft-N2 │N≡N│ inertes Gas kräftige Bindung.
Knöllchenbakterien können N2 spalten und organ. gebund. N
herstellen. In gebundener Form: Nitrate; KNO3 Salpeter,
Chilesalpeter
N in Aminosäuren → Eiweiß
R-C-COOH R-C-OOH
 │ │
│ │
NH2 NH
│
COOH C=O
│
C-NH2
C-NH2
│
R R
Beginn des Lebens mit Enzymen → sehr
Störanfällig → Gerinnung: Neuerfindung Nucleinsäuren. Gebrauch: für
Phänotyp: Eiweiß; Genotyp: Erbmaterial.
Metabolismus von N: Aufnahme anderer Zellen.
Ausscheidung: Harnstoff,
Harnsäure H2O + O=C(NH2)2→Enzym→
CO2 + 2NH3 Menschen fehlt dieses Enzym → Nieren.
Urimie: Eintrübung des Bewußtseins →
Gehirn wird vergiftet.
→ Dialyse: Blut rinnt durch
Schläuche (aus Zellophan) die in Waschlösung tauchen (Leitungswasser und
Salze). Zellophan ist für kleine Moleküle (Harnstoff) durchlässig! Stoffe die
nicht herausgewaschen werden sollen, müssen in Waschlösung vorhanden
sein.(Zucker, Salze). Es bleiben aber größere Moleküle zurück →
Langfristig trotzdem Vergiftung → Einlagerung in Gewebe.
Bakterien im Harn: Können Harnstoff zersetzen
→ Urin stinkt.
Haber-Bosch-Verfahren Aus N+H → NH3
Linde-Verfahren: Luft wird verflüssigt und N
abgetrennt.
Katalysatoren: Kristallines Fe: (1mol) N2
+ (3mol) 3H2 → (2mol) 2NH3.
Reaktion versucht dem äußeren Zwang
auszuweichen.
Möglichst hoher Druck und niedrige
Temperatur. → 500°C ist Kompromiß zwischen Schnelligkeit und Ausbeute
(15%). Reaktionsgase werden durch Brause geschickt: NH3 wird
ausgewaschen.
Praxis: durch Strömungsgeschwindigkeit nur
10% Ausbeute,nichtreagierter N + H wird zurückgeleitet.
Problem: H → Versprödung der Rohre →
Legierungen.
Verwendung von NH3: Speicherung
als flüssiger NH3 (-33°C), fest bei -77°C
Weiterverarbeitung im
Ostwald-Verfahren: Er wird oxidiert:
N2O3
NO2 Pt-Netz (angeheizt) heizt dann
von selbst → NH3 verbrennt.
NH3 O2
Produkte: Stickoxide in H2O
→ HNO3
HNO3 + NH3 →neutralisieren
→ NH4NO3 Dünger.
NH3 mit H2SO4
→neutr. → (NH4)2SO4
NH3 mit H3PO4
→ Superphosphat → (PO4)2(SO4)3
NH3: stechend riechendes
Gas, leicht verflüssigbar, leicht zu verfestigen.
Das freie e-Paar schwingt auf und
ab. _ →
Ausgenützt für Atomuhren.

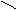
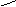 N
N
H H
H
flüssiges NH3 sehr H2O ähnlich: polar, relativ
ungiftig: Eigendissoziation: 2NH3 → NH4+
+ NH2-.Als Lsg.-Mittel wenn H2O ungeeignet, in
zu hoher conc. Verätzung. Löst metallisches Natrium: dunkelblaue Lsg.
(Reaktionsmittel).
NH4+: Ammoniumion:
Lewis-Säure, ähnlich groß wie K+
NH3: Lewis-Base (e-Donator)
NH4Cl:
Salmiak/Ammonchlorid, weißer Film, als Elektrolyt in Batterien, als Lötstein.
Diammid der Kohlensäure: (H2CO3)
= Harnstoff.
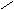
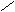 Carbaminsäure(Insektizide:
Carbamate) → Zersetzen sich relativ schnell an Luft/Licht/H2O.
In der Medizin als Schlafmittel. NH2 ONH4
Carbaminsäure(Insektizide:
Carbamate) → Zersetzen sich relativ schnell an Luft/Licht/H2O.
In der Medizin als Schlafmittel. NH2 ONH4
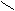
 O=C Ammoncarbamat:O=C
O=C Ammoncarbamat:O=C
OH
NH2
Hirschhornsalz: Mischung von
Ammoncarbamat mit (NH4)2CO3 als
Backtreibmittel für Lebkuchen.
Stickstoffwasserstoffsäure: HN3 →
H + N=N=N (gibt H+ ab um symmetrisch zu werden).
Salze: Azide: →Ionische
Azide z.B.: NaN3; →Kovalente Azide: PbN3, AgN3
instabil: Inizialzünder.
Initialzünder in Patrone. PbN3
zündet TNT.
Nitride: BN, CN, WN, FeN :
nicht stöchometr. Verbindungen, Einlagerungsverbindungen. Hartmetalle→für
Bohrer, Meißel, Ahnlich wie Carbide(WC,BC); Einsatzzeit der Bohrer ist
wichtig.
NH: Hydrazin: Aus NH3 +
Hypochlorid ; H2N-NH2;
mit O2 brennbar; Raketentreibstoff; zusetzen zu Kesselwasser als
Ox-Schutz für Leitungsrohre. O2 und Hydrazin wird zu H2O
reduziert. Atzend, Kanzerogen, Im Labor: Hydrazinsulfat: Handschuhe.
NH2OH: Hydroxylamin durch
Reduktion aus Nitraten oder Nitriten in Technik zur Erzeugung von Caprolactam,
Braucht man für Nylon, Perlon, reißfester als Stahl.
Stickoxide N-O:
N2O
NO
NO2
N2O3
N2O5
→Entstehen nebeneinander durch
reagieren von N2 + O2.
Distickstoffoxid N2O: (Lachgas) →
Narkosegas, Treibmittel für Schlagobers (Schmeckt leicht süßlich)
reagiert nicht mit H2O.
Alle übrigen ergeben mit H2O
aggressive Säuren( sie sind Anhydride).
 2HNO3 -H2O
→ N2O5
2HNO3 -H2O
→ N2O5
H2N2O4 - H2O
→ N2O3 Dämpfe: braun und giftig.
NOX: reingewaschen in
den Boden nach Blitzen: 10% der Weltdüngung. Vor allem in den Tropen.
→kurzzeitig: in der Lunge
Salpeter-/Salpetrige Säure → ätzend.
→langfristig: Canzerogen
Salpetrige Säure ist instabil aber Nitrite
sind es.
3HNO2 → HNO3 +
2NO + H2O
Disproportionierung
NO: giftig, wird aber vom
Körper hergestellt. Zur Gefäßsteuerung → Blutdruckregelung, Erhaltung der
Körpertemperatur. NO führt zur Erschlaffung des Muskels → Erweiterung der
Gefäße.
Bei Herzanfällen: Nitroglyzerin → Wird
gelutscht → Schleimhäute nehmen es auf. → Gefäße erschlaffen →
es wird weniger Blut in die Gefäße geschaufelt → Weniger Anstrengung für
Herz. Aber nur für kurze Zeit günstig da Unterversorgung des Körpers mit O2.
Viagra hemmt NO-Abbauendes Enzym
(Ursprünglich Herzmittel).
Salze der Salpeter und
Salpetrigen Säure:
Nitrite: NaNO → Pökelsalz,
Fleischkonservierung
Fleisch
bleibt rosa, Keine Oxidation von Hämoglobin.
Wachstum
der Erreger der Fleischvergiftung wird gehemmt(stärkstes bekannt. Gift→1μg
Tod)
Im
Sauren Magen mit Aminosäuren und Pepsin→ reagieren mit Nitrit→Nitrosamine→ cancerogen, diese entstehen auch im
Zigarettenrauch, grillen.
Nitrit im Trinkwasser: bei Kleinkindern
gefährlich. Es wirkt auf Hämoglobin (kann keinen O2 mehr
transportieren) → blaß, Wachstumsstörungen.
Nitrate: als Düngemittel,
Sprengstoffe, TNT
Nitrite + Nitrate: als Beize für
Autokarosserien, vor dem Lackieren.
N-Kreisläufe: enthalten in
Lebewesen, Boden, Luft. → Umwälzung: N-Bindende Bakterien; durch Blitze;
beim Abbau von Lebewesen.
PHOSPHOR: eines der ältesten
bekannten Elemente.
→ Phosphate: Adenintriphosphat;
Nucleinsäurephosphate: Wichtig für den Körper → 70 kg ATP wird täglich
durch Atemkette umgesetzt. Intrazellulär wird Phosphatpuffer verwendet. Genug
wird mit der Nahrung aufgenommen. Trotzdem wird zugesetzt H3PO4
Säuerungsmittel.
H3PO4: ist stark
viskos, ätzend. Stärker als Essigsäure, keinen Dampfdruck. Bei Durchfall →Cola(viel
Phosphorsäure, Zucker).
Polyphosphate 1. In Lebensmittel wegen
hygroskopischer Wirkung (Fleisch, Brot): Feuchtigkeit bleibt erhalten.
2.
als Dünger
3.
Phosphatbäder: Oberflächenkorrosionsschutz(Primer)
Ca3PO4: Apatit:
Calziumphosphat. Mit H2SO4 wird Phosphorsäure frei →
großtechn. Herstellung.
CaSO4: Gips
Knochen bestehen aus CaH5(PO4)3
+ Anion; z.B.: Hydroxyapatit +H
Zahnschmelz: Fluoroapatit → Manchmal
Trinkwasser mit NaF versetzt.
Phosphor: (von Leuchten)
Reduktion von CaPO4 + Kohle unter
Lichtabschluß ~400°C → P4 verdampft, unter H2O
aufgefangen → weißer Phosphor (wachsartige Masse).
Phosphor hat 11 Modifikationen.
Weißer Phosphor: reaktiv → Umwandlung in
andere Formen → reagiert mit O2.
Verwendung: chem.
Industrie. Auflösen in Schweröl→ Napalm (Phosphor-Benzintropfen entzünden
sich an der Luft.
reaktionsärmere Formen: roter Phosphor(Mischform)
beigemischt bei Zündflächen der Zündhölzer. Grauer + schwarzer
Phosphor(metallartig, reaktionslos).
Phosphate: Im Waschmittel um
Ca auszufällen → Überdüngung der Gewässer.
Diphosphate, Triphosphate: Durch erhitzen
wird H2O abgespalten→
O O
 ║ ║
║ ║
HO-P-OH HO-P-OH
│ │
OH OH
Calgon: Diphosphat: als
Kalkschutz, wirkt nicht düngend.
Knochenkrebs: Diphosphat kann
verabreicht werden, wird eingebaut statt Hydroxyphosphat → Knochen können
nicht abgebaut werden.
Niederdosiertes Diphosphat: Kalziumabbau wird
gestoppt, nach Menopause. → Calzitonin: beeinflußt Ca-Haushalt. Fluorid:
Hydroxyphosphat, Knochen wird stabil.
Phosphane: P-H-Verbindungen.
PH3: Gas. P2H5: Diphosphan (flüssig), giftig,
ätzend, brennbar, stinkend, Tauschen H gegen Metall: Mg2P2:
Magnesiumphosphan, riechen in dünner Konzentration gut→Moschus.
Phosphan: aus Meer(abgestorbenes organ.
Material.) → Meeresgeruch, Mit Feuchtigkeit: H3PO4:
Düngung der Küstenregion.
Phosphiate: z.B.: Mg2P2
(In Sand: Mit Meerwasser leuchtet es + bildet Nebel), sehr hart, manche
Halbleiter (Indiumphosphat).
Leuchtreaktionen: Phosphor: oxidiert zu
Phosphat unter Lichtabgabe. → Chemolumeniszens.
P4O10 Anhydrid der H3PO4.
Phosphorpentoxid(P2O5): weißes lockeres Pulver, hygroskopisch,
als Exsiccatorpulver, kann man nicht trocknen, wirkt aber besser.
Phosphorhalogenide: P2Cl4
Verwendung als Chlorierungsmittel.
Orthophosphorsäure ≙ Monophosphorsäure H3PO4
Meta- oft zyklisch
Poly-
ARSEN: Vorkommen als Sulfid: As2S3.
(Auripigment).
Als
Oxid: (als Verunreinigung in Flugstaub- Cu-Gewinnung→ im Rauchfang.)
Auch
einige Modifikationen: gelb(≙weißer Phosphor)
grau Halbleiter) Metall- leicht verdampfbar.
Giftig: Arsenverbindungen sind giftig
(ähnlich Hg. reines ist kaum giftig allerdings ist As reaktiver.)
As ist S ähnlich- Brücken zwischen As →
statt S-Brücken.
As-Oxid ist kraftsteigernd.
Auf Dauer schädigend- Krebserregend. Im Körper eingebaut: As-Vergiftung an
Haaren nachweisbar. Arsenspiegelnachweis (über As-Wasserstoff). Lithiumboroxid
+ HCl+ Probe → H*.
Arsenoxidpulver: Macht Haut blasser
→ Schminke. In Huterzeugung als Filzwalzmittel→ Langzeitvergiftung
der Hutmacher. Schädlingsbekämpfung.
Arsen kommt auch in Boden vor→späteres
eindiffundieren in Leichen → keine Vergiftung.
Verwendung: Metallurgie: Pb-Akku: ½%As
As: Als Malerfarbe(Cupfer-Arsen).
Arsenite/Arsenate: Arsen-O2-Säuren
 z.B.: H3AsO4: Arsensäure
z.B.: H3AsO4: Arsensäure
H3AsO3:
arsenige S. nur Bedeutung für
Mineralogie
ANTIMON: Sb(Stibium),
Letternmetall (Pb, Sb, Bi, Sn)
SbS: schwarzes Pigment: als Wimperntusche,
Lidstift, in Agypten.
Sb: kaum giftig
kaum größere Vorkommen, begleitend zu Cu, Ag.
Grauspießglanz, Weißspießglanz
Modifikationen: gelb, grau
SP: 360°C
Antimonpulver: Sb2 + Fe-Pulver
reduziert.
Verwendung: Als Lagerschalen,
Sauerstoffsäuren, Antimonwasserstoff für Nachweise.
BISMUT: Bi2O3
Bismutokker(-oxid) als Schminke bekannt. Kommen mit anderen der Gruppe als
Sulfide oder Oxide vor.
SP: 271°C
Früher Arzneimittel gegen Magengeschwüre.
Für Schmelzsicherungen; Metallabgüsse,
Kosmetik;
Bismutoxichlorid: Perlmutglanz (Schminke)
Bismuthydrid (flüchtig)
relativ edel, leicht schmelzend
HALOGENE: Brom + Iod: Haben
hohen Dampfdruck, starke Ox-Mittel
FLUOR: Gasförmig, das
reaktionsfähigste Element, zersetzt sogar H2O
2 H2O + 2F2 → 4HF
+ O2 → keine wäßrige Fluorlösung!
Vorkommen: Flußspat: CaF2
CaF2 + H2SO4
→ 2HF + CaSO4 HF +
NaF/KF → anod. Ox.→ F2 mit Graphitelektroden
Aufheben in Mg-Tanks: bilden innen MgF2-Schicht
welche kein weiteres Fluorgas durchläßt.
C-F: Teflon: mit Fluor abgesättigte KWs →
hitzebeständiger Kunststoff (~300°C) als Pfannenbeschichtung. Auch für chem.
Geräte und Getriebezahnräder.
Chem-, Temperaturstabil.
Mensch: Fluor im
Zahnschmelz (Ca5(PO4)3F) Aufnahme durch NaF.
HF: 38% durch Destillation.
chem. schwach → schwach dissoziert; bringt Fluoride in Wunde
(Gewebetoxisch).
Aufbewahrung: In Plastikflaschen: es reagiert
mit Silikaten. SiO2 + HF → SiF4↑
Fluorierte Verbindungen: z.B.: Cortison,
Valium + F → Rohibnol (gesteigerte Wirksamkeit).
Rohibnol: Bewußtseinslücken für Zeit der
Wirkung.


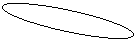

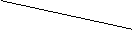




 HF: Starke
Wasserstoffbrücken → nur deshalb flüssig.
HF: Starke
Wasserstoffbrücken → nur deshalb flüssig.
20°c
HF HF 38% H2O 100%
DESTILLIEREN/SIEDEDIAGRAMM
Azeotrop: Verhält sich wie Reinstoff (vgl.
96% Alkohol)
CHLOR: chloros: griech.:
gelbgrün → Chlorophyll(=Blattgrün)
Schweres gelbgrünes Gas, stark oxidierend,
ätzend, erstickend
Vorkommen: NaCl, KCl, AgCl2
Gewinnung: aus Meerwasser (3%
Salz, 2,5 % NaCl)
Chlor-Alkalielektrolyse:
In wäßriger Lösung mit Diaphragma





 2Na+
+ 2e- → 2Na0
2Na+
+ 2e- → 2Na0



 2Na0
+ 2H+ → 2H + 2Na+ 2NaOH
2Na0
+ 2H+ → 2H + 2Na+ 2NaOH
2H2O
→ 2H+ + 2OH-
2Cl-
→ Cl2 + 2e-
Diaphragma
= poröse Trennwand
Ergebnis: H2, Cl2 +
NaOH
Ohne Diaphragma:
In der Kälte: Anode: Cl2;
Kathode: H2
NaOH: Cl2 + 2OH- →
HOCl- (Hypochlorige Säure) + H2O + Cl-
Ist nicht stabil, nur ihre Salze. z.B.: NaOCl
Hypochlorid: zur Desinfektion in Bädern im H2O.
Umkehrung: 3NaOCl → Cl2 + Cl-
In der Hitze: 3 OCl- → O3Cl- (Chlorat)
3
ClO3- → ClO4 (Perchlorat)
Chlorid: Cl-
Hypochlorid: OCl- →
Hypochlorige Säure
Chlorit: O2Cl- →
Chlorige Säure
Chlorat: O3Cl- →
Chlorsäure; einigermaßen stabil
Perchlorat O4Cl- →
Perchlorsäure; sehr stabil
Halogensauerstoffsäuren: z.B.: HOCl: Säurestärke
nimmt in umgekehrter Reihenfolge zu.
Halogenwasserstoffsäuren: z.B.: HF, HCl, HBr,
HI Säurestärke nimmt von links nach rechts zu.
Transport: Cl2 in
Stahlflaschen als Gas. → Es bildet sich Schutzschicht aus Chlor und
Metall.
Cl2-Gas in H2O löslich
(auch: Br, I, nicht: F) → Hypochlorige / Salzsäure
Cl2 →H2O→
HCl + HOCl (zerfällt)
Halogene machen gerne Radikalreaktionen:
Homolytische Spaltung.
Startreaktion meist durch Licht (UV)
Start Cl2 → UV → Cl.
+ Cl.
Halogene s2p5
E=h*(c/λ)
EBindungsenergie von Cl2
h.Plank'sches Wirkungsquantum.
c.Lichtgeschwindigkeit
λ.Wellenlänge (UV)
Kette Cl. + H2 → HCl + H. CHLORKNALLGASREAKTION
H. + Cl2
→ HCl + Cl.
 Abbruch: Cl. +
Cl. → Cl2
Abbruch: Cl. +
Cl. → Cl2
H. + H. → H2
Cl. + H. → HCl Radikale rekombinieren sich. Reaktion
sehr energiereich: H2 → 2H. es ist drittes Teilchen
vorhanden, welches freiwerdende e- aufnimmt; oder Reaktion findet an
der Wand statt → Energie wird auf Wand übertragen. → Verhältnis von
Volumen zu Oberfläche muß günstig sein, damit kein Abbruch. (Großes Volumen,
kleine Oberfläche).
Kettenstart: durch
Peroxoverbindungen NaO. aus Na2O2, H2O2
→ 2HO.
Radikalreaktionen: sehr schnell,
schwer zu kontrollieren (damit sie nicht erlahmt oder durchgeht); Reaktionen
geben viel E ab (Explosion). → pos. Rückkopplung. entstehende Produkte
verstärken Ursache. Normalfall: neg. Rückkopplung.
Chlorknallgasreaktion: Analog mit Br, I
BROM: einzig flüssiges Nichtmetall,
hoher Dampfdruck; löst sich in H2O → Bromwasser. dem Chlor
ähnlich aber weniger reaktionsfähig. Chlor verdrängt Brom → KBr mit Cl2-Gas
→ KCl+ Br
flüssiges Brom: kaum Bedeutung.
Halogenbromide: Fotografie, AgBr
(90% der Bromide)
Früher Bromide als Beruhigungsmittel.
Vorkommen: Meerwasser: Algen.
IOD: Vorkommen: in
Meerespflanzen → Gewinnung durch abweiden.
Iodat: in Chilesalpeter:
NaNO3; NaIO3
metallisch glänzende Blättchen; großer
Dampfdruck.
Löst sich in H2O nicht so gut.
Alkohol besser → braune Färbung.
sehr gut löslich in KBr oder Chloroform,
Benzol/Toluol.
Gewinnung aus Chilesalpeter
mit schwefeliger Säure → HI + H2SO4
HI + IO3- → I2
reinigen durch Sublimieren
Mensch: In Schilddrüse für
Thyroxin. Überproduktion: sehr dünne Menschen, agil.
Unterproduktion: In Kindheit:
Kretinismus; Beim Erwachsenen: Verlangsamung → Kropfbildung.
Kaliumiodidtabletten: 127I
nicht radioaktiv: Schilddrüse hat jetzt soviel Iod aufgenommen, daß es im Falle
des Falles kein radioaktives Iod mehr aufnehmen kann. → Es wird
ausgeschieden 131I.
Radioaktives Iod zur Diagnostik.
Halogendampflampen: Lichtausbeute ist
direkt proportional zur Temperatur.
Im
Kolben Spuren von Iod,Quarz möglichst eng am W-Draht~3000°C
 Wolfram
verdampft→schlägt sich am Quarz nieder→WI4flüchtig→
Wolfram
verdampft→schlägt sich am Quarz nieder→WI4flüchtig→
 an
Glühwendel: W+I. → entfleuchendes W wird immer wieder zurück geführt.
an
Glühwendel: W+I. → entfleuchendes W wird immer wieder zurück geführt.
 Entladungslampe: Anode Kathode Ionisiertes
Gas
Entladungslampe: Anode Kathode Ionisiertes
Gas
1000
V
Neonlampe: rot durchsichtig.
Na: gelb
Hg: gibt UV-Licht ab → Beschichtung mit
Leuchtstoff, welcher im sichtbaren leuchtet. 3 Linien werden vom Gehirn als
weiß definiert.
Wolframlampen: Kontinuierliches Strahlen.
Ionisierte Gase senden einzelne Linien des
Spektrums aus, erhitzte Feststoffe ein ganzes Spektrum.
Van Arkel - De Boer Verfahren (Aufwachsverfahren); 1924.
Zur Gewinnung reinster Metalle: Ti, W, V,.(Nur teure Metalle weil
Verfahren teuer).

 Iodkristalle
Iodkristalle
Heizdraht:
2000°C
Rohtitan 800°C
I2 + Ti → TiI4 →
am Draht Zersetzung: Ti lagert sich ab + Iod fängt sich neues Ti.
Früher: Glühbirne → Eddison Glühdraht
aus Kohlefaser: Verkohlte Bambusfaser
→Auer von Welsbach: Wolfram als
Glühdraht.
ÜBERGANGSMETALLE:
Nebengruppenelemente
d-Orbitale werden eröffnet + aufgefüllt:
d-Gruppen-Elemente, alles Metalle
Unterscheiden sich in Schmelzpunkt,
Redoxverhalten
Vorherrschende Bindungsform: Komplexbildung:
Zentralatom, Liganden
Koordinationszahl: Wie viele Liganden.
z.B.: [Fe(CN)6]2-
Bindung über e-Paare = kovalente
Bindung, e-Paar kommt nur von einem Partner.
 CN
CN
 CN CN
CN CN
Fe
 CN CN
CN CN
CN
Vergleiche: Cl. + Cl. →
Cl-Cl Atombindung
│C≡N│ + Fe2+
Es gibt 5 d-Orbitale: Die freien Orbitale
werden von Liganden aufgefüllt.
Komplexchemie: Cotton-Wilkinson "Anorganische
Chemie".
Meist Zentralatom:
Lewis-Säure, pos. Metallion → Bindung zwischen Lewis-Säure und
Lewis-Base.(Halogenide: Chloro-, Bromo-, Iodo-Komplexe)
Liganden: negative
Ionen; oder nichtbindende e-Paare. (Aqua: O; Amin: N; Carbonyl:CO).
Anlagerungskomplexe: Zentralatom und
Ligand sind verschieden geladen, oder verschieden polar. z.B.: Cu-Aqua-Komplex.
Durchdringungskomplexe: Zentralatom hat
freie Orbitale, Ligand hat freie e-.
Beide Komplexarten kommen gemeinsam vor,
jeder Komplex hat bestimmte Anteile von beiden.
[Fe(CN)6]eher Durchdringungskomplexe
(sehr stabil)
CuSO4.5H2O →
Aquakomplex Anlagerungskomplex nicht stabil. H2O kann im
Trockenschrank abgespalten werden.
Magnetismus:
Magnet. Feldstärke.H

 HA HA
HA HA
He- He-
H außen stärker H
innen stärker
als im Stoff als außerhalb
DIAMAGNET PARAMAGNET
Kreisendes e- verursacht
Magnetfeld (→ Umlaufendes e- im Atom erzeugt Magnetfeld)
Paramagnet.: Magnetfeld richtet
e- im Atom aus → Magnetfeld wird verstärkt.
Diamagnet.: Magnetfeld des e-
ist der äußeren Feldstärke entgegengerichtet → 1/100 des Paramagnetismus.
Ferromagnetismus: Stoffeigenschaft
von Fe, Co, Ni, 104-105
größer als Paramagnetismus.
Stoff: Weiß'sche Bezirke: Paramagnet. Momente
sind gleichgerichtet (unter Mikroskop sichtbar).
In einem größerem Teil heben sich die
Eigenschaften auf. Bringt man Fe in Magnetfeld, richten sich diese Bezirke aus.
Ausrichtung der Weiß'schen Bezirke = Phasenübergang bei Curie'scher
Temperatur: Umwandlung der ausgerichteten Bezirke (Entmagnetisierung).
Alle Stoffe sind Dia- + Paramagnetisch;
Ferromagnet ist aber Gruppeneigenschaft.
Diamagnetismus: hervorgerufen
durch e-Paare (abgeschlossene Schalen). Fast alle organischen
Stoffe, sowie die Mehrzahl der Elemente + organischen Verbindungen.
Paramagnetismus: Eigenschaft eines
einzigen e- in einer Schale.
Fast alle Stoffe haben Diamagnetismus
(abgeschlossene Schalen). Beiträge jeder Schale summieren sich.
Paramagnetismus ist seltener: ungepaarte e-
(=Radikale)
Ganz selten mehrere ungepaarte e-
(ODiradikal). NO, NO2, Na, Al. Best. Übergangsmetalle, kaum
Metalle.
Messung der magnet.
Suszeptibilität: =Aufnahmefähigkeit für ein magnetisches Feld.
χ=∆H(außen-innen)/H(außen)
χbezogen auf mol oder Vol.
χges = χdia +
χpara(Tempabhängig)
Messung mit Cavendish-Waage:
Wird Kontakt geschlossen und Stoff ist param.→
Feldlinien konzentrieren sich nach innen→ er wird
scheinbar schwerer.
Permanent-Magnet: Fe-Stab in elektrischem
Feld → magnetisch bei bestimmtem C-Gehalt. Wegnahme des äußeren
Magnetfeldes → Fe bleibt magnetisch.
Nicht-permanent-Magnet: Fe-Stab im elektr.
Feld → magnetisch, beim Abschalten Verlust der Eigenschaft. (Weicheisen).
KRISTALLFELDTHEORIE:
Jeder Ligand erzeugt bestimmtes Feld
(elektromagnet.). Zentralatom liegt im Feld der Liganden.

 ZAd-Gruppenelement.
ZAd-Gruppenelement.













 Y X X
Y X X
Z Y Z
dzy dxy dxz dx2-y2 dz2
3e--- Aufenthaltsarten zwischen
den Achsen
2e--- Aufenthaltsarten in
Achsenrichtung
Oktaeder: Liganden können sich besser in dzy,
dxy, dxz Einfügen, als in dx2y2 oder dz2.








 dzy dxy dxz dx2y2 dz2 dz2 dx2y2 ∆Kristallfeldenergie
dzy dxy dxz dx2y2 dz2 dz2 dx2y2 ∆Kristallfeldenergie
dzy dxy dxz
freies
Atom mit
Liganden
Orbitale die mit Liganden wechselwirken
werden ungünstiger → Energiereicher
 dz2
dz2
∆Oktaeder dxy E=h*(c/λ) .. Energie liegt im Bereich sichtbarem Lichts
∆Oktaeder = h*(c/λ)
λ.200-1200 nm
Aufspaltung der d-Orbitale: durch
Lichteinwirkung werden e- angehoben. z.B.: Blaues Licht wird
absorbiert → gelb-rot.
Ligandenfeldtheorie erklärt Farbigkeit der
Komplexe: bestimmtes Licht wird absorbiert, die Komplementärfarbe wird gesehen.
→Hauptgruppenelemente-Verbindungen:
Weiß
Durchdringungskomplexe: stärker farbig.
Anlagerungskomplex: CuSO4.5H2O H2O Kristallwasser→Liganden.
↓
Ionenverb.
Salz. zwischen Cu + H2O →
Komplexbildung,
SO4:
Atombindung
Bei H2O-Abspaltung wird Cu weiß.
Silikagel: SiO2 Co, Ni
Aufspaltung der d-Orbitale (blaues Glas).
wenn feucht: H2O-Moleküle
verdrängen Oxide: rosafärbung.
Tetraederanordnung der
Liganden: Benachteiligung der Orbitale die zwischen den Achsen liegen.
Quadratisch/Planar: Feld nimmt mit 1/r2
ab (Quadrat der Entfernung). → Tetragonale Verzerrung.
Oktaeder absorbiert genau eine Wellenlänge.
Bei Tetragonaler Verzerrung: mehrere Wellenlängen werden absorbiert. →
Entartung der d-Orbitale wird durch Komplexbildung aufgehoben.
Planar: → Messung der
absorbierten Wellenlänge → rechnerisch: auf Kristallfeldenergie.
Intensität der
Farbe: liegt an der Symmetrie→ nicht alle e-Zustände sind
erlaubt, dies hängt von der Geometrie des Grundzustands + des angeregten
Zustands ab.
KMnO4: stark unsymmetrisch →
stark farbig.
MnII + H2O: sehr
symmetrisch → blaß gefärbt
Ab d4 - d7 high oder
low spin Komplex
d1-d3 + d8-d10
nur 1 Möglichkeit.
High und Lowspin hängt von magnet. Feldstärke
des Liganden ab.
D1-GRUPPE:
Scandium
Yttrium
Lanthan
Actinium
Alle sind Metalle, sind ähnlich wie
metallisches Ca; erdalkalimetallähnlich, elektropositiv, reaktionsfähig,
Vorkommen nur in gebundener Form: Oxide und Phosphate. Metalloxide der
Lanthanide → f-Schale
wird aufgefüllt.kommen sehr häufig vor, aber nie in angereicherter Form →
gleichmäßige Verteilung; wurden nie aufkonzentriert wie Eisen
Monazit: Gemisch von
Phosphaten + Metallen der d1-Gruppe.
Trennung der Elemente: Chromatographisch:
löst alle Metalle auf und trennt sie an großer Kationensäule d=0,5 m, paar m
Länge + 1 l Monazit in der Säule eluiert + mit Säure heruntergewaschen
(PH-Wert, verdünnt → Ionenstärke → Kationen werden hintereinander
ausgewaschen).
Extraktion: Ausgangsform wird
in Phosphate oder Nitrate übergeführt, dann werden sie mit organ.
Komplexbildnern (Benzin, Öl) extrahiert → extrahieren bei versch. pH.
Verwendung verschiedener Komplexbildner für größere Mengen, besser
automatisierbar. In Nucleartechnik: Aufarbeitung von verbrauchten Brennstäben
(Gemisch aus fast allen Elementen in spaltbarer Form.) → Uranstab soll
vor Einsatz nicht radioaktiv sein, auch bei Bomben: nur spaltbar, aber nicht
radioaktiv.
Es entstehen viele seltene Erden:
automatisierte Trennung (kein Mensch darf sich nähern). Aufgelöst in konz. HNO3.
Fraktionieren
Yttrium: Yttriumvanadat:
(Vanadiumsalz): leuchtet auf e-Beschuß rot auf (→ Roter Punkt
in Bildröhrl). Yttriumaluminiumoxide: künstlich erzeugte Schmucksteine →
Diamanten mit Fremdatomen dotiert → bestimmte Färbung (Granat). Für
techn. Zwecke.
LANTHAN: +Lanthanide
(ähnliche Substanzen)
Lanthanoxide: Beimischung für
optische Gläser → größerer Brechungsindex.
Optische Geräte meist 1 Linse mit Lanthanoxid
→ hohe Brechkraft (Zoomobjektive), bricht leicht.
Gemisch aus Lanthansalzen: Imprägnierung für
Gasglühstrümpfe.
14 Lanthanelemente: sehr ähnlich,
Auftrennung schwierig.
Lanthan ist Katalysator in
Rauchgasentschwefelung.
CER: Cer + Fe 50:50 =
Feuerstein in Feuerzeug.
SAMARIUM: Dauermagnet z.B.:
Kopfhörer.
YTTRIUM-COBALT: Dauermagnet, hohe
Sprungtemperatur → elektrischer Widerstand geht gegen Null →
Supraleiter.
Sprungtemperatur: 2 e- koppeln
sich zu einem Boson meist beim absoluten (Vodka) Nullpunkt.
D2-GRUPPE: Titan, Zirkonium,
Hafnium
ZIRKONIUM: ZrSiO4:
Inselsilikat, ZrO2: Zirkonerde. Herstellung analog Titan.
Wie Titan aber Dichte wie Stahl. Die selben
Eigenschaften, hohe Korrosionsresistenz. Hat kleinen Neutronen-Einfangsschnitt
→ n gehen durch. → Hülle von Brennstäben.
Innen sind Pellets aus 235UO2(Natur:0,7%),
238UO2(99,3%). Zur Spaltung benötigt man 7% und 93%.
Anreicherung: Überführung in UF6;
In Zentrifugen aufkonzentriert durch mehrere Zentrifugen hintereinander,
Rückführung in UO2 (spaltbar, aber nicht radioaktiv). Für Bomben:
Plutonium oder reines 235UO2. Im Inneren Entstehen
aggressive Spaltprodukte + Gase → Überdruck: Zirkonium hält diesen
Ansprüchen stand.
Verwendung: Zirkon: Schmuckstein
ZrO2: sehr hohen
SP, für feuerfeste Steine. Leuchtet beim erhitzen(→früher Lampen).
Metall: Brennstäbe, Implantate, als Stahllegierungsbestandteil (Schußfester
Stahl).
HAFNIUM: Korrosionsfest,
aber schwer wie Blei. sehr großer n-Einfangsquerschnitt (Abtrennung von
Zr!). Zwischen La + Hf großer Sprung im
Atomradius. Hf ist viel kleiner als der des La.
Zr + Hf sind gleich groß → Lanthanidenkontraktion.
Atomradius sollte von Zr zu Hf zunehmen. Haben gleiche Eigenschaften nur
doppelt so schwer und unterschiedl. SP. Gleiche e-Konfiguration.
Auch: Niob + Tantal. Weiter rechts im PSE
nimmt der Effekt ab. Sehr hoher e-Einfangsquerschnitt →Wie Bor
als e-Einfänger, stoppt Reaktionen.
TITAN: Schmelzpunkt von Fe
aber halbe Dichte ρ = 4g/cm3; stark, leicht, teuer →
darum maskulin. Sonst wie Stahl, es korrodiert aber nicht, und erzeugt keine
Allergien (→ Implantate).
Häufigstes Element, aber keine Lagerstätten,
häufiger als Cu, Zn, C, N; auch Meerwasserfest: Schiffsteile.
3 Mineralien die abgebaut
werden: Ilmenit: FeTiO3; Perowskit:
CaTiO3; Rutil, Anatas, Brookit: TiO2 je nach
Kristallstruktur.
Technische Gewinnung aus
Ilmenit: Fe + T: gleicher Atomradius → Ersetzen sich im Kristallgitter.
Abtrennung des Fe
Reduzieren mit C nicht möglich, da sonst Ti-Carbit
entsteht
2 Verfahren:
Chlorid-Prozess: Führt zum Titan als Metall.
Funktion: Krollverfahren:
Im elektrischen Lichtbogen, sehr hoher Temp. unter Zusatz von Koks(C). Das
Mineral wird aufgeschmolzen reduziert. Fe wird zu Fe0 reduziert, es
entstehen aber auch Carbide. Großer Teil des Fe ist dann abgetrennt.
→Ti-Schlacke: Ti-Oxid,
Fe-Oxid, TiC; Sie wird gemahlen und bei 800°C mit Cl2-Gas umgesetzt →TiCl4
kovalente Verbindung ═ Destillierbar (Fraktionierung: reines TiCl4).
TiCl4 wird mit metallischem Mg umgesetzt → MgCl2 +
Ti unter Schutzgas Argon + 800°C schwimmt Titan als Schwamm auf flüssigem MgCl2.
→ Abtrennung. Aus Ti-Schwamm wird noch TiCl4 durch verdampfen
entfernt. → Ti zu 99% rein.
Sulfat-Prozess: führt zu TiO2:
Wird als weißes Farbpigment verkauft und so verwendet. Vergilbt nicht, ist
ungiftig, strahlend weiß →Malerfarbe, Kunststoffe, Füllmaterial in
Papier.
Hauptproduzent: USA wegen
Hauptlagerstätten.
Verfahren: für Endprodukt:
TiO2. Viel billiger.
Vermahlenes FeTiO3
wird digeriert mit H2SO4; Fe2(SO4)3
geht in Lösung. TiOSO4 Titanoxisulfat wird abfiltriert mit Alteisen
beschickt (=Reduktionsmittel) → FeSO4
Mischung wird konzentriert
und abgekühlt: FeSO4 kristallisiert aus + wird abgetrennt.
TiOSO4
hydrolysiert: Ti(OH)2 nicht sehr stabil → H2O
abspaltung durch glühen → TiO2.
Verbindungen: Nicht besetzte, halb besetzte
und ganz besetzte Schalen sind besonders stabil.
Verwendung: TiIV als Nachweis für Peroxide / mit
Peroxiden Ti-Nw.

 O
O
 Ti4+ + H2O2
→ [OH -Ti ]+ Peroxitantanyl- (Orange)
Ti4+ + H2O2
→ [OH -Ti ]+ Peroxitantanyl- (Orange)
O
Ether bildet Peroxide: Vor Reaktion prüfen,
sonst Explosion. Ist aber nicht mit TiO2 machbar.Zu inert.
Ti-Carbit/ -Borit/ -Nitrid sehr hart (fast wie Diamant)
Ti-Blech anlaufen lassen → Farben sehr
intensiv → Schmuck.
Ti-Sandwich-Verbindungen:
 Cyclopentadien
Cyclopentadien
 Fe0
/Fe2+/Fe3+-Atom eingelagert
Fe0
/Fe2+/Fe3+-Atom eingelagert
Ferrocen







Cl
Cl
Bicyclopentadianyltitandichlorid: In organ.
Lösungsmittel löslich.
Sind sehr stark gefärbt (Ligand)
Sind Magnet → flüssiger Magnet:
Lautsprecher, kühlt ihn.
Katalysatoren: Ti-Halogenide: Ziegler-Natta-Verfahren
zur Polymerisation von Ethylen → PE.
Bei
niederem Druck, Temp.
Es
liefert Maßgeschneiderte Polymere, die bestimmte Eigenschaften haben.
RC RC CR
C C C
RC CR CR
C C C
RC RC RC
verschiedene
physikalische Eigenschaften.
Bei radikalischer
Polymerisation statische Verteilung der Endprodukte; hier wird durch Katalysatoren
der Reaktand in bestimmter Stellung festgehalten + reagiert. → Es gibt
definierte Endprodukte.
Titanhydrid: Einlagerungen von Ti + H.
Ti kann große Mengen H
speichern / Einlagern ═ Schwamm- bis zum 3000-fachen des Eigenvolumens →
für Entwicklung neuer Motoren (H-Verbrennung). Ti als Metall sehr teuer.
VANADIUM: Vanadis (nordische Göttin der
Schönheit). Es macht viele farbige Verbindungen, nicht selten aber nirgends
angereichert.
Vorkommen: VO3- Vanadat PbVO3;
YVO3; Vanadiumglimmer (Schichtsilikat).
Mahlen der Erze, rösten
mit Soda → NaVO3 ist H2O-löslich. Mit H2SO4
ansäuern → Es fallen Polyvanadate aus (gefärbt). → glühen V2O5
Vanadiumpentoxid hoher Schmelzpunkt. → Reduktion mit metallischem Ca →
techn. Vanadium.
Reduktion mit
Fe und V2O5: → Ferrovanadium (Legierung).→Werkzeugstahl.
V ist
schwer in Lösung zu bringen: nur mit Cl2 oder F-Gas bei hoher
Temperatur.
Halogenide
sehr niedrige SP: VF5 20°C; SiedeP: 48°C.
VF4:
grün.
NIOB
+ TANTAL: kommen gemeinsam vor als Niobat NbO3-, Tantalat
TaO3- ,in Brasilien.
Niob:
engl.: Columbium.
Herstellung: Schmelzflußelektrolyse der komplexen Fluoride.
Erz →HF od. H2SO4→ K2[NbOF4],
Na2[TaOF7] → durch Red zum Metall vorher Trennung
der Salze mit Ionenaustauscher + Komplexextraktionsmittel.
Als
Metall: hoher Schmelzpunkt Nb: 2000°C; Ta: 3000°C. Korrosionsfest.
Legierung aus Nb und Zr: sehr hohe Sprungtemperatur → Supraleitfähige
Magneten →Kernresonanzgeräte. Verwendung als Implantate. Tantal ist
schwer, Niob schwer wie Stahl → Stahllegierung für hochtemperaturfeste
Stähle.
CHROM: chromos: Farbe.
Vorkommen: Cr-Eisenstein (Fe-Cr-Spinell): FeCr2O4
hart, farbig; PbCrO4
Herstellung: Aus FeCr2O4 Chromit
Erz
gemahlen: Im Drehrohrofen bei 1000°C mit Soda und Kalk behandelt (Oxidativer
Aufschluß) → FeO unlösl., NaCrO4/CaCrO4 löslich. →
Trennung.
H2SO4
→ Produkt: Kaliumchromat, Kaliumdichromat im sauren → pH-Abhängig.
Chromat reduzieren
mit C → Cr2O3 + Al → Metall. Chromit + C + Fe
→ Chrom + Fe + CO2↑ Ferrochrom Verhältnis: 1:1.
Aus wässrigen
Chromsalzen elektrolytisch Chrom abscheiden.
Stoßstange:
verkupfert + in Chrombad (Stoßstange als Kathode). Fe ist gegen Rost geschützt.
Bei Nichtleitern: Leitbarmachen
durch einpudern mit Graphitstaub, darunter Plastik. Heute: Aufdampfen im
Hochvakuum.
Chrom: metallisch blau →
kalt. Durch Vernickeln, Versilbern reflektiert es Wärmere Farben →
Weichere Oberfläche.
Cr
bildet CrO2 → mit
oxidierenden Säuren nicht angreifbar (Oxidschicht ist inert) Mit nicht
oxidierenden Säuren eher angreifbar.(HCl).
Wichtiger
Stahllegierungsbestandteil.
Cr-Salze: Zum Teil giftig,
Krebsauslösend, zum Ledergerben (mit Cr-Alaum: fest, widerstandsfähig).
Chromleder: Autositze, Schuhe. Eiweißketten werden sofort verbunden, sodaß
Bakterien oder Enzyme sie nicht spalten können. (Cr-Komplex). Eingelegt in Saft
aus Galläpfeln und Eichenrinde: Leder wird weicher.