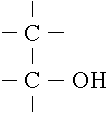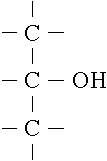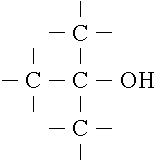Alkohole
I.
Definition
II.
Kurzer geschichtlicher Überblick
III. Einteilung der Alkohole
IV.
Eigenschaften
V.
Herstellung, alkoholische Gärung
VI.
Verwendung
VII. Wirkung
alkoholischer Getränke
I. Definition
Unter Alkohol
versteht der Chemiker eine Gruppe von organischen Verbindungen, die im
Molekülaufbau die Hydroxyl - Gruppe, auch OH-Gruppe genannt, besitzen.
Eine solche Gruppe,
die die chemischen Eigenschaften einer Stoffgruppe prägt, nennt man in der
Chemie auch eine funktionale Gruppe.
II. Kurzer geschichtlicher Überblick
Im
Volksmund versteht man unter Alkohol eine trinkbare Flüssigkeit, die
Rauschzustände hervorruft und in zahlreichen alkoholischen Getränken enthalten
ist.
Bier
und Wein sind seit tausenden von Jahren in allen Hochkulturen bekannt und
akzeptiert.
Schon
die alten Griechen und Römer kannten die Wirkung von Wein.
Allerdings
war es im alten Rom den Frauen verboten, Wein zu trinken.
Bierrezepte
kannten bereits die Sumerer im 4. Jahrtausend vor Christus.
Das
Getränk war in Germanien schon vor der Römerzeit bekannt.
Die
Germanen tranken es nach einer Überlieferung des römischen Schriftstellers
Tacitus aus riesigen Trinkhörnern, die mit Bier und Honigmet gefüllt waren.
Sie
betrieben mit den Römern Handel, lieferten Bier und erhielten dafür
Gebrauchsgegenstände.
Im
Mittelalter übernahmen die Mönche die Herstellungstechnik und entwickelten die
Kunst des Bierbrauens.
Bekannt
ist sicherlich das Reinheitsgebot, das bereits 1516 in Bayern erlassen wurde.
Dieses
gebot gilt im Wesentlichen noch heute.
Es
besagt, dass für das Bierbrauen nur Malz, Hefe, Hopfen und Wasser verwendet
werden dürfen.
III. Einteilung der Alkohole
Alkohole, die von
den Alkanen (gesättigte Kohlenwasserstoffe) abgeleitet werden können, heißen
Alkanole.
Sie erhalten den
Namen des jeweiligen Alkans und dazu die Endsilbe -ol (z.B.
Methan - Methanol).
Nach der Anzahl der
Hydroxy- oder auch kurz OH-Gruppen kann eine Einteilung in einwertige und
mehrwertige Alkohole getroffen werden.
Die einwertigen
Alkohole, zu denen der allgemein bekannte, trinkbare Alkohol Ethanol gehört, besitzen
nur eine Hydroxy-Gruppe.
Die allgemeine Formel der Alkanole lautet: CnH2n+1OH
Auf diese Weise
erhält man die homologe Reihe der einwertigen Alkohole:
Methanol CH3OH, Ethanol C2H5OH, Propanol, Butanol, >>> Hecadecanol (Cetylalkohol)
C16H35OH
Homologe Reihe
Eine homologe Reihe ist eine Reihe von Verbindungen, in der sich jede
Verbindung von der folgenden durch die gleiche Atomgruppe unterscheidet.
Sind in einem Molekül mehr als eine OH-Gruppe chemisch gebunden,
handelt es sich um ein mehrwertiges Alkohol.
Alkohole mit zwei oder drei OH-Gruppen werden als zwei- bzw. dreiwertig
(Diole/Triole) und Alkohole mit vier oder mehr OH-Gruppen allgemein als
Polyalkohole (Polyole) bezeichnet.
Die wichtigsten mehrwertigen Alkohole sind Glykol und Glycerin, doch
darüber hinaus gibt es auch in der Natur noch viele andere.
Auch Zucker sind mehrwertige Alkohole.
Ab dem Propanol kann zusätzlich zwischen primären, sekundären und
tertiären Alkoholen unterschieden werden, je nach der Zahl derjenigen
Kohlenstoffatome, die an das C-Atom gebunden sind, an dem auch die OH-Gruppe
sitzt:
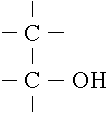
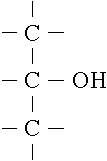
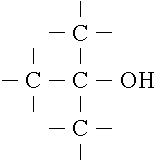
primär (Ethanol) sekundär (2-Propanol) tertiär (2-Methyl-2Propanol)
IV. Eigenschaften
Die einwertigen
primären Alkohole mit 1-3 C-Atomen sind alle leichtbewegliche Flüssigkeiten,
die mit Wasser leicht mischbar sind, diejenigen mit 4-12 Kohlenstoffen
präsentieren sich als ölige Flüssigkeiten und sind mit Wasser fast nicht mehr
mischbar, die höheren Alkohole sind bei Raumtemperatur fest, geruchlos,
wachsähnlich und nur noch in organischen Lösungsmitteln löslich.
Mehrwertige Alkohole
sind mit Wasser besser mischbar, ihre Süßigkeit steigt im allgemeinen mit der
Anzahl der OH-Gruppen.
Die Siedepunkte der
primären Alkohole können mit der Zahl der OH-Gruppen mal 100°C angenähert
werden, wobei auch mit jedem zusätzlichen C-Atom der Siedepunkt um
durchschnittlich 19°C steigt und Ethanol C H OH bei 78°C liegt. Die
sekundären und tertiären Alkohole besitzen tiefere Siedepunkte als die
primären.
Für den Chemiker
präsentieren sich die Alkohole als sehr reaktionsfähig, wobei sich auch
deutliche Unterschiede zwischen primären, sekundären und tertiären Alkoholen
zeigen.Als eine der wichtigsten Alkoholreaktionen gilt die Oxydation (chemische
Reaktion eines Stoffes, in der Regel mit Sauerstoff), die bei primären
Alkoholen zweimal (Zwischenstufe: Aldehyd, Endprodukt: Carbonsäure), bei
sekundären einmal (zum Keton) und bei tertiären nicht möglich ist.
Eine Zusammenfassung
wichtiger Eigenschaften einiger Alkohole zeigt nachfolgende Tabelle:

Siedepunkt
Der Siedepunkt stellt die Bedingungen (Siedetemperatur und Siededruck)dar,
welche beim Phasenübergang eines Stoffes von der flüssigen in die gasförmige
Phase vorliegen, was man als Sieden oder Verdampfen bezeichnet.
Schmelzpunkt
Als
Schmelztemperatur bezeichnet man die Temperatur, bei der ein Stoff schmilzt,
das heißt vom festen in den flüssigen Aggregatzustand übergeht. Die
Schmelztemperatur ist abhängig vom Stoff, im Gegensatz zur Siedetemperatur aber
nur sehr wenig vom Druck (Schmelzdruck). Schmelztemperatur und Druck werden zusammen
als Schmelzpunkt bezeichnet.
V. Herstellung, alkoholische Gärung
Der
trinkbare Alkohol wird durch alkoholische Gärung gewonnen.
Alkohole
für technische Zwecke gewinnt man durch Anlagerung von Wasser an Ethen
(-->Ethanol), aus Synthesegas (-->Methanol) oder durch eine Oxosynthese
(z.B. Propanol oder -->Cetylalkohol).
Beim
letzteren Verfahren bringt man Ethen oder Propen mit Synthesegas (Kohlenstoffmonoxid-Wasserstoff-Gemisch)
mit Hilfe eines Katalysators zur Reaktion.
Im Folgenden möchte ich kurz auf die alkoholische Gärung eingehen: Unter einer Gärung versteht
man die Umwandlung von organischen Stoffen durch Enzyme oder Mikroorganismen.
Dabei wandeln sich die Stoffe zu Verbindungen mit
einfacherem Molekülbau um.
Es existieren verschiedene Gärungsformen, die nach dem
entstehenden Produkt benannt werden.
Die Gärung ist wie die Atmung ein Stoffwechselvorgang, der
Energie frei setzt.
Das Prinzip der Herstellung von trinkbarem Alkohol ist schon seit dem Altertum
bekannt.
Die alkoholische Gärung findet überall in der Natur statt,
wenn aufgeplatztes Obst oder süße Säfte bestimmten Bedingungen ausgesetzt
werden.
Bei technischen Prozessen muss das Ausgangsmaterial oft
zuerst verzuckert werden.
Bierherstellung
Bei der Bierherstellung
werden Gerstenkörner zunächst einer Quellung und Keimung ausgesetzt. Vorhandene
Enzyme (Amylasen) wandeln dabei die Stärke in Zucker um.
Auf diese Weise erhält man das
zuckerhaltige Malz, das die Bierhefen vergären kann.
Die Vergärung von Zuckern (Glucose, Fructose, Maltose) zu Ethanol wird von
Hefepilzen und Hefeenzymen gesteuert.
Diese kommen praktisch überall in der
Luft vor. Bei der Bierherstellung werden sie zusätzlich hinzugefügt.
Gärungen können bei unterschiedlichen
Temperaturen stattfinden.
Vereinfacht lässt sich die
alkoholische Vergärung von Traubenzucker durch folgende Reaktionsgleichung
beschreiben:
Glucose
(Traubenzucker) ---Hefeenzyme--->
Ethanol + Kohlenstoffdioxid
C6H12O6
---Hefeenzyme---> 2 C2H5OH
+ 2 CO2
Das entstehende
Kohlenstoffdioxid bewirkt ein Aufschäumen während der Gärung.
Bei der Bierherstellung verfärbt sich
dieser Schaum durch Verunreinigungen nach und nach bräunlich. Danach unterzieht
man das Produkt noch einer Nachgärung, die bis zu 4 Monaten dauern kann,
während die Hauptgärung nach 8-10 Tagen abgeschlossen ist.
Bei obergärigen Bieren findet die Gärung
bei 12-15°C statt, bei untergärigen Bieren bei 5-10°C.
Weinherstellung Bei der Weinherstellung werden die Trauben zunächst zu
einem Brei zerquetscht.
Man erhält eine 'Maische', die
je nach Weinsorte gepresst oder von den Hülsen und Schalen befreit wird. Der
gepresste Traubensaft wird als 'Most' bezeichnet.
Er gelangt in großen Behältern zur Gärung.
Die meist metallenen Behälter sind oben
luftdicht mit einem wassergefüllten Gährrohr verschlossen, so dass das
entstehende Kohlenstoffdioxid entweichen kann.
Nach der Haupt- und der Nachgärung wird
der entstandene Wein von der Maische abgetrennt und nach einer Schwefelung für
längere Zeit unter Luftabschluss bei 10-15°C gelagert.
Bei dieser 'Kellerbehandlung'
entwickelt der Wein sein erwünschtes Aroma.
Die Menge an gebildetem Ethanol hängt vom Zuckergehalt der Ausgangslösung und
von der Alkoholkonzentration ab, die die Hefeenzyme gerade noch ertragen
können, ohne die Gärung einzustellen. Daher können Biere mit einem
Alkoholgehalt von mehr als 6 Volumenprozent und Weine mit mehr als 16% Alkohol
nicht mehr durch Gärung hergestellt werden.
Eine Konzentration des Alkohols, z.B. bei
der Herstellung eines Weinbrandes oder einer anderen Spirituose, erhält man
durch Destillation.
Die Destillation ist ein thermisches
Trennverfahren, um ein flüssiges Gemisch verschiedener ineinander löslicher
Stoffe zu trennen.
Die Siedepunkte der einzelnen Komponenten
liegen hierbei relativ nah zusammen.
Typische Anwendungen der Destillation sind
wie schon gesagt das Brennen von Alkohol und das Destillieren von Erdöl in der
Raffinerie.
VI. Verwendung
Alkohole spielen heute in der Chemie eine vielfältige Rolle. Alkohole sind
wichtige Zwischenprodukte in der chemischen Industrie. Mit Alkansäuren
entstehen Ester, die als Geruchs- und Geschmacksstoffe in der Lebensmittel- und
Parfümindustrie verwendet werden, z.B. Essigsäureethylester. Alkohole dienen
auch als Lösungsmittel für Farben und Lacke (alle kurzkettigen Alkohole) oder
für die Duftstoffe bei der Parfümherstellung (Ethanol). Durch Oxidation erhält
man Aldehyde und Ketone (s.o.) oder Alkansäuren, z.B. Essigsäure. Alkohole
eignen sich auch als Treibstoffe für Kraftfahrzeuge oder Raketen. Die V2-Rakete
im 2. Weltkrieg verbrannte in 70 Sekunden 3500kg Ethanol mit 5250kg Sauerstoff.
Mehrwertige Alkohole finden sich z.B. in Hautcremes (Glycerin) oder in
Frostschutzmitteln (Ethylenglycol).
Ja und schließlich hat Alkohol als Getränk in vielfältiger Form eine große
Bedeutung und Verbreitung.
VII. Wirkungen alkoholischer Getränke Alkohol gehört zu den wenigen Stoffen, die direkt ins Blut
gehen.
So ist es möglich, das
Alkohol schon wenige Sekunden nach dem ersten Schluck "in den Kopf steigt".
In den nächsten 30 Minuten wird der größte
Teil des Alkohols vom Blut aufgenommen und im ganzen Körper verteilt.
Die Wirkung des Alkohols in Abhängigkeit
von der getrunkenen Menge zeigt die folgende Tabelle:
 Quelle: Schulbuch Chemie 10 II/III
Quelle: Schulbuch Chemie 10 II/III
Der
Genuss einer bestimmten Alkoholmenge kann bei verschiedenen Personen
unterschiedliche Wirkungen zeigen.
Die
Auswirkungen lassen sich auch nicht genau vorhersagen.
Sie
hängen z.B, vom Körpergewicht ab, aber auch von der Gewöhnung und von der
augenblicklichen Verfassung des Trinkenden.
So
kann schon eine Alkoholmenge die normalerweise keine Wirkung zeigt, auf
nüchternen Magen oder nach körperlicher Verfassung zu schweren Auswirkungen
führen.
Besondere
Gefahren des Alkohols bestehen in der Beeinträchtigung der richtigen
Selbsteinschätzung und in möglichen gesundheitlichen Schäden.
Regelmäßiger
Alkoholkonsum kann zur Sucht und Abhängigkeit, also zur Alkoholkrankheit
führen.
Da
Alkohol in Leber und Nieren abgebaut wird, kann er zu schweren Leber- und
Nierenschäden führen. Aber auch andere Organe sind gefährdet, so treten z.B.
häufig auch Gelenk- und bleibende Gehirnschäden sowie Nervenentzündungen auf.